丛艳君,任发政
(1.北京工商大学食品学院,食品添加剂与配料北京高校工程研究中心,北京市食品风味化学重点实验室,北京100048;2.中国农业大学食品科学与营养工程学院,北京 100083)
人嗜碱性粒细胞肿瘤细胞系KU812F检测牛乳及其替代品致敏性方法的建立
丛艳君1,任发政2,*
(1.北京工商大学食品学院,食品添加剂与配料北京高校工程研究中心,北京市食品风味化学重点实验室,北京100048;2.中国农业大学食品科学与营养工程学院,北京 100083)
比较牛乳及其替代品释放组胺的能力,以建立体外细胞检测牛乳及替代品疑似过敏原组分致敏性的检测方法。以嗜碱性粒细胞KU812F为研究对象,通过牛乳过敏患者血清的孵育,使细胞处于致敏状态,再以牛乳及其替代品过敏原作为激发物,使细胞脱颗粒释放组胺。结果表明:利用嗜碱性粒细胞KU812F检测牛乳及替代制品组胺释放量的方法具有较高的可靠性及重现性,细胞释放组胺的量与过敏原的剂量相关,在一定的剂量范围内,组胺的释放率与过敏原的剂量呈正比,组胺释放率达到最大之后,组胺释放率与剂量呈负相关。
KU812F;组胺;过敏反应;牛乳粉
嗜碱性粒细胞在食物超敏反应中起着初级效应细胞的作用,过敏原初次进入过敏体质的机体,刺激机体产生特异性IgE抗体,IgE与嗜碱性粒细胞结合,形成致敏嗜碱性粒细胞,此时机体处于致敏状态,相应变应原再次进入处于致敏状态的机体,通过与致敏嗜碱性粒细胞表面紧密相邻的特异性IgE“桥联”结合,使致敏的细胞脱颗粒,释放组胺、白三烯、激肽和嗜酸性粒细胞趋化因子等一系列具有生物活性的介质,介质作用于效应器官与组织,而产生一系列的临床症状[1-2]。
组胺释放是评价过敏原致敏性的常用指标,常用的方法是从过敏患者或致敏动物的周边血液中提取嗜碱性粒细胞进行即时检测,评价过敏原致敏性[3-5],但是提取靶细胞的复杂工艺及细胞不能长期保存的缺点限制了此种方法的长期连续应用。本实验应用株化的嗜碱性粒细胞肿瘤细胞系建立体外检测牛乳及替代品疑似过敏原组分致敏性的检测方法。
1 材料与方法
1.1 材料与试剂
实验材料包括液态奶和婴儿配方粉,液态奶有牛乳、山羊奶、驴奶和水牛奶,每种液态奶是50份奶样的等体积混合物,巴氏杀菌奶由实验室自制(牛奶65℃加热30min),另外从全国收集母乳100份,混合备用,婴儿配方粉包括伊利金冠、雀巢能恩、多美滋金盾,水解物配方粉和氨基酸配方粉由伊利集团技术中心友情提供。
KU812F美国模式菌种收集中心(ATCC)、组胺定量检测试剂盒(ELISA) 上海江莱生物科技有限公司;胎牛血清、细胞培养板、人IgE抗体 美国Sigma公司。
1.2 仪器与设备
S21-1恒温磁力搅拌器 上海司乐仪器厂;YCP-100 CO2细胞培养箱 北京市英博联科技发展有限公司;TDL-50B低速离心机 上海安亭仪器厂;XDS200-PH倒置相差显微镜 北京中显恒业仪器仪表有限公司。
1.3 方法
1.3.1 牛奶过敏患者血清的筛选
牛奶过敏患者血清由北京大学第三医院皮肤科友情提供,牛乳过敏患者筛选参照文献[6-7],收集的血清用于细胞的敏化。本研究将5份血清混合,混合血清特异性IgE含量为41.2kU/L。
1.3.2 KU812F嗜碱性粒细胞的复苏、传代培养
根据KU812F说明书提供的方法进行细胞复苏、传代培养实验。37℃水浴复苏细胞株,在超净台内把盛有细胞株的冻存管从水浴中取出,用体积分数70%乙醇溶液擦拭冻存管管身,然后从冻存管中吸取0.5mL细胞液,缓慢添加以5mL/min的速度加入4.5mL RPMI-1640培养基(含体积分数10%的胎牛血清、2mmol/L L-谷氨酸、10mmol/L 4-羟乙基哌嗪乙磺酸缓冲溶液(HEPES)中,125×g离心5min,取细胞。
以培养基重悬细胞,稀释到2×105,在培养箱中培养,次日更换培养基,以后一般每2d更换一次培养基。
取细胞密度不超过1×106/mL的细胞液,125×g离心5min,除去上清液,加入新的培养液,吹打成细胞悬液,计数、分装。
1.3.3 组胺释放率的测定[8]
选用12孔细胞培养板,每孔2mL细胞悬液,每孔1×106个细胞,用台式液(137mmol/L NaCl、2.7mmol/L KCl、1.8mmol/L CaCl2、1.1mmol/L MgCl2、11.9mmol/L NaHCO3、0.4mmol/L NaH2PO4、5.6mmol/L葡萄糖组成的溶液,pH7.2)洗2次,加入25μg/mL的人的IgE抗体,以促进细胞高亲和力受体高效表达,然后加入牛乳过敏患者混合血清2mL,加入10μg/mL抗人IgE抗体,37℃孵育4h,然后4℃、300×g离心10min,测定上清组胺含量,所得结果作为阳性对照。
取12孔细胞培养板,每孔2mL细胞悬液,每孔1×106个细胞,用台式液洗2次,加入25μg/mL的人IgE抗体,以促进细胞高亲和力受体高效表达,然后加入待测样品,待测过敏原样品一般以1.0μg/mL为初始质量浓度,以10倍梯度稀释,再加入牛乳过敏患者血清,37℃孵育4h,然后立即4℃、300×g离心10min,测定待测样品上清液组胺含量。以不加待测样品作为阴性对照组。将细胞用超声破碎后,测定总组胺含量。上清液和细胞内外总组胺含量均用组胺定量检测试剂盒进行测定。
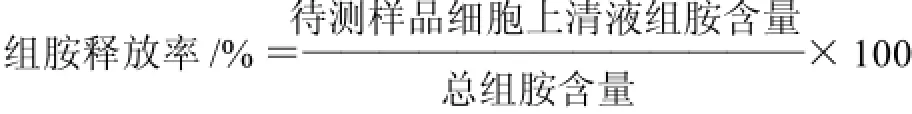
1.4 方法的重现性与精确度的验证
选用12孔细胞培养板,每孔2mL细胞悬液,每孔1×106个细胞,用台式液洗2次,加入25μg/mL的人IgE抗体,然后再加入10μg/mL抗人IgE抗体,加入牛乳过敏患者血清,37℃敏化4h,然后4℃、300×g离心10min,测定上清组胺含量。以不加抗人IgE抗体作为阴性对照组。将细胞用超声破碎后,测定总组胺含量。上清液和细胞内外总组胺含量均用人组胺定量检测试剂盒进行测定。其中抗人IgE标准品配成5种不同的稀释质量浓度——0.001、0.01、0.1、1、10μg/mL,每种质量浓度均计算嗜碱性粒细胞释放组胺率/%。以批内误差和批间误差来表示该方法的精确度与可靠性。批内误差:抗人IgE质量浓度作4次重复,计算标准差,以其组内变异系数表示批内误差;批间误差:不同时间重复此实验,测定组胺释放率,计算出标准差和变异系数,以组内变异系数表示批间误差。
2 结果与分析
2.1 精确度实验
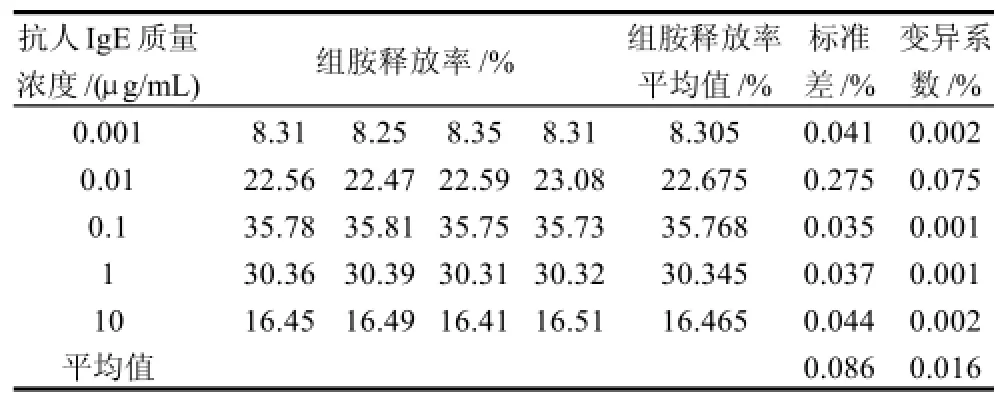
表1 组胺释放率的批内精确度Table 1 Intra-plate accuracy of histamine release
由表1可知,变异系数最大值为0.075%、最小值为0.001%,批内具有较好的精确性。比较3次测定的组胺释放量的平均值,求出各质量浓度的批间标准差,再计算出变异系数,结果见表2,变异系数在0.001%~0.002%,批间同样具有较好的精确性。鉴于批内、批间数据的精确性,因此利用嗜碱性粒细胞KU812F检测牛乳及替代制品组胺释放量的数据具有较高的可靠性及重现性。
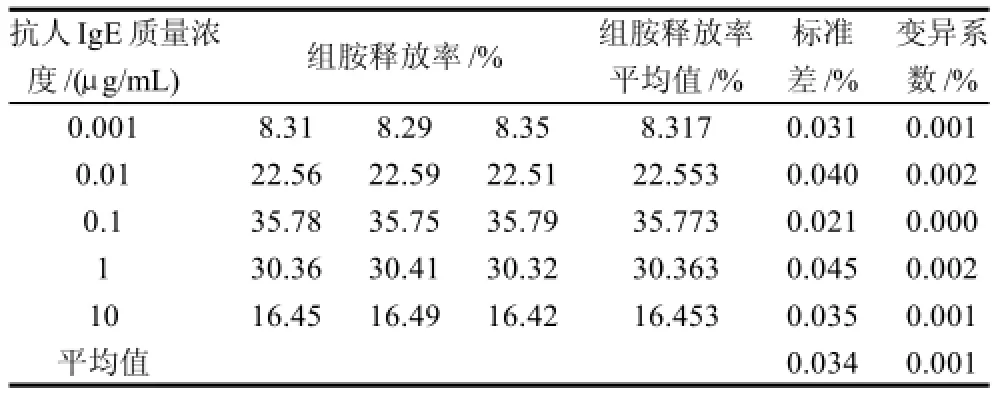
表2 组胺释放率的批间精确度Table 2 Inter-plate accuracy of histamine release
2.2 KU812F测定牛乳及其替代品致敏性的应用
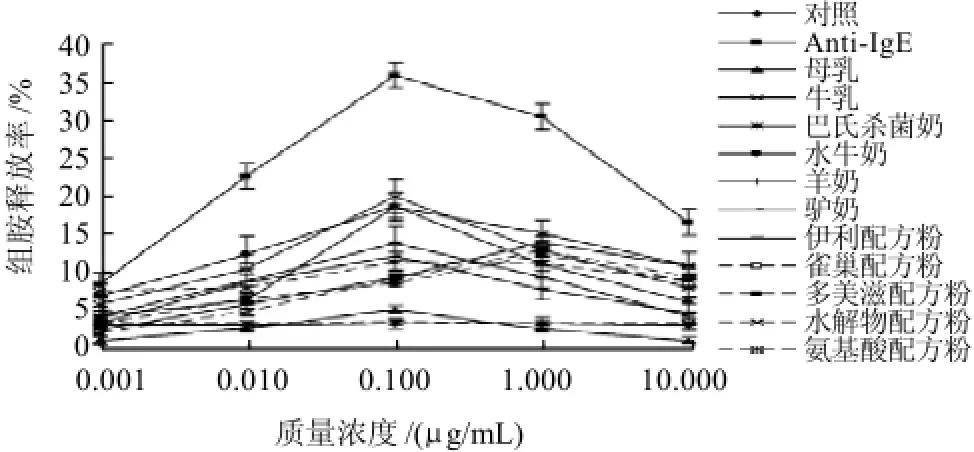
图1 KU812F检测牛乳及替代品组胺释放率Fig.1 Histamine release from KU812F basophils after sensitization with cow milk or its substitutes at different concentrations
如图1所示,嗜碱性粒细胞组胺释放率与过敏原的激发量密切相关,原料乳和巴氏杀菌奶在0.1μg/mL时组胺释放率最大,全蛋白婴儿配方粉在1μg/mL时组胺释放率最大;不同乳及制品间,在同一剂量粗蛋白激发下,组胺释放率均存在差异,如在0.1μg/mL条件下,牛奶作为细胞过敏原刺激物组胺释放率最高,其次依次为水牛奶、羊奶、驴奶,4种全蛋白配方粉组胺释放率也较低,差异显着(P<0.05)。氨基酸配方粉组胺释放率高于全蛋白配方粉的组胺释放率。
3 讨 论
现有技术中用于检测牛乳过敏原的方法有多种。其中,皮肤试验在临床应用极为普遍[9],被认为是过敏原评价的较为合理的方法,这种方法虽简便、快速,但其操作不安全、假阳性或假阴性的结果出现率也很高。体外检测技术主要有酶联免疫吸附实验、放射过敏原吸附实验、高压液相层析法等[10-12],放射免疫法费用昂贵且放射性同位素易污染环境,高效液相法仪器成本高、耗时费力,酶联免疫方法快速、方便,目前在过敏原检测方面应用比较多,但是这种方法主要对食品中致敏蛋白质检测比较准确,如果产品中蛋白质水解为多肽,由于包被洗涤过程中部分多肽的流失,ELISA方法就不准确了。相对而言,组胺释放试验更接近临床试验,已作为皮肤试验的有效替代方法,在许多免疫学研究中得到比较广泛的应用[13-14]。
本研究以嗜碱性粒细胞KU812F为研究对象,通过牛乳过敏患者血清的孵育,使细胞处于致敏状态,再加入牛乳及其替代品过敏原,使细胞脱颗粒释放组胺,比较牛乳及其替代品释放组胺的能力。Yamaguchi等[15]研究表明,在细胞培养过程中加入IgE可以提高细胞高亲和力受体表达水平,本研究在测定组胺释放率实验中,为了提高组胺的释放量,提高实验数据的精确性,使用了人IgE抗体。Shim等[8]用人嗜碱性粒细胞肿瘤细胞系KU812和KU812F探索了体外检测过敏原过敏性反应的方法,发现KU812F传代稳定,分化能力强,易于培养,具有较高的FсεRI表达能力和组胺释放能力。本实验在该研究基础上优化了细胞传代培养的方法,验证了过敏原激发嗜碱性粒细胞释放组胺方法的可重复性和精确性,并成功应用于乳及乳制品致敏性的检测。嗜碱性粒细胞组胺释放量与过敏原的激发量密切相关,原料乳和巴氏杀菌奶在0.1μg/mL组胺释放率最大,全蛋白婴儿配方粉在1μg/mL组胺释放率最大,这种现象出现的原因可能是由于不同样品粗蛋白中过敏原含量差异所致;不同乳及制品间,在同一剂量粗蛋白激发下,组胺释放率均存在差异,原因可能是在加工过程中乳蛋白与其他成分发生复杂的反应屏蔽了作用表位所致。
本研究初步探索了牛乳及制品体外激发嗜碱性粒细胞释放组胺的规律,广泛应用于过敏原致敏性的筛选检测有待于深入研究,要建立统一的检测标准,包括明确血清孵育量、细胞株培养保存方法、过敏原激发量、组胺检测方法等。
[1]周光炎. 免疫学原理[M]. 上海∶ 上海科学技术出版社, 2007∶ 229.
[2]EI-AGAMY E I. The challenge of cow milk protein allergy[J]. Small Ruminant Research, 2007, 68(1)∶ 64-72.
[3]KOPPELMAN S J, WENSING M, ERTMANN M, et al. Relevance of Ara h1, Ara h2 and Ara h3 in peanut-allergic patients, as determined by immunoglobulin E Western blotting, basophil-histamine release and intracutaneous testing∶ Ara h2 is the most important peanut allergen[J]. Clin Exp Allergy, 2004, 34(4)∶ 583-590.
[4]SUHR M, WICKLEIN D, LEPP U, et al. Isolation and characterization of natural Ara h6∶ evidence for a further peanut allergen with putativeclinical relevance based on resistance to pepsin digestion and heat[J]. Mol Nutr Food Res, 2004, 48(5)∶ 390-399.
[5]OPARA E I, OEHLSCHLAGER S L, DAY L, et al. An in vitro cell based model for assessing the potential of allergens to release mediators through the cross-linking of IgE[J]. Toxicology in Vitro, 1999, 13(1)∶811-815.
[6]DOCENA G, ROZENFELD P, FERNANDEZ R, et al. Evaluation of the residual antigenicity and allergenicity of cow s milk substitutes by in vitro tests[J]. Allergy, 2002, 57(2)∶ 83-91.
[7]COCCO R R, JRVINEN K M, SAMPSON H A, et al. Mutational analysis of major, sequential IgE-binding epitopes in as1-casein, a major cow s milk allergen[J]. Journal of Allergy and Clinical Immunology, 2003, 112(2)∶ 433-437.
[8]SHIM S Y, ICHIKAWA A, YAMASHITA M, et al. Construction of an in vitro allergy reaction evaluation system using human leukemia cell lines[J]. Cytotechnology, 2002, 40(1/2/3)∶ 75-83.
[9]EYSINK P E. Relation between IgG antibodies to foods and IgE antibodies to milk, egg, cat, dog and/or mite in a cross sectional study[J]. Clin EXP Allergy, 1999, 29(5)∶ 604-610.
[10]KECK-GASSENMEIER B, BENET S, ROSA C, et al. Determination of peanut traces in food by a commercially-available ELISA test[J]. Food and Agricultural Immunology, 1999, 11(3)∶ 243-250.
[11]MONERET-VAUTRIN D A, KANNY G, FREMONT S. Laboratory tests for diagnosis of food allergy∶ advantages, disadvantages and future perspectives[J]. Allergy Immunology (Paris), 2003, 35(4)∶ 113-119.
[12]LIM T K, NAKAMURA N, MATSUNAGE T. Flow immunoassay for detection of wheat allergen using an anion exchange column and alkaline phosphatase conjugated IgE[J]. Biotechnology Techniques, 1998, 12 (6)∶ 445-449.
[13]PALMER G W, DIBBERN D A, BURKS A W, et al. Comparative potency of Ara h1 and Ara h2 in immunochemical and functional assays of allergenicity[J]. Clinical Immunology, 2005, 115(3)∶ 302-312.
[14]REESE G, VIEBRANZ J, LEONG-KEE S M, et al. Reduce allergenic potency of VR9-1, a mutant of the major shrimp allergen Pen a1 (tropomyosin)[J]. Journal of Immunology, 2005, 175(12)∶ 8354-8364.
[15]YAMAGUCHI M, SAYAMA K, YANO K, et al. IgE enhances FcεRI receptor 1 expression and IgE-dependent release of histamine and lipid mediators from human umbilical cord blood-derived mast cells∶ synergistic effect of IL-4 and IgE on human mast cell Fcε receptor 1 expression and mediator release[J]. Journal of Immunology, 1999, 162(9)∶5455-5465.
Construction of an in vitro Allergy Reaction Evaluation Method for Cow Milk and Its Substitutes Using Human Leukemia Cell Line KU812F
CONG Yan-jun1,REN Fa-zheng2,*
(1. Beijing Key Laboratory of Food Flavor Chemistry, Beijing Higher Institution Engineering Research Center of Food Additives and Ingredients, School of Food and Chemical Engineering, Beijing Technology and Business University, Beijing 100048, China;2. College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China)
This study aimed to construct an in vitro cellular assay for suspected allergenic components of cow milk and its substitutes using human leukemia cell line KU812F, an immature prebasophillic cell line based on their histamine release ability. KU812F was differentiated into basophils by incubation with serum from cow milk allergic people. The release of histamine from differentiated KU812F cells was monitored after sensitization with either cow milk or its substitutes. The results showed that this in vitro assay was highly reliable and reproducible in determining histamine release from KU812F cells after respective sensitization with cow milk and its products. Cow milk and its substitutes differed in their histamine release ability. Cow milk allergen induced histamine release in a dose-dependent manner. Specifically, a positive relationship was observed in a defined range of allergen dose, followed by a negative relationship after maximum histamine release.
KU812F;histamine;allergy;cow milk powder
TS207.3
A
1002-6630(2011)14-0202-04
2011-03-12
北京市教育委员会科技计划面上项目(KM201110011003)
丛艳君(1978—),女,讲师,博士,研究方向为功能乳制品。E-mail:congyj@th.btbu.edu.cn
*通信作者:任发政(1962—),男,教授,博士,研究方向为功能乳制品。E-mail:renfazheng@263.net



