熊 涛,冯 超,谢明勇
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
植物乳杆菌NCU116微胶囊制备工艺的优化设计
熊 涛,冯 超,谢明勇
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
利用乳清蛋白中的β-乳球蛋白在低pH值及胃蛋白酶存在的情况下,依然能够保持结构完整的特性,本实验以脱脂乳作为壁材的成分之一,对植物乳杆菌NCU116微胶囊的制备工艺条件进行研究。在单因素试验的基础上,应用响应面分析法优化植物乳杆菌微胶囊制备条件。以经过人工胃液处理后微胶囊中包埋的活菌数为响应值,优化后的最佳工艺条件为:海藻酸钠质量浓度2.68g/100mL,氯化钙浓度0.20mol/L,脱脂乳质量浓度4.17g/100mL。以该工艺条件制备的植物乳杆菌NCU116微胶囊粒径为1.12mm,包封率在73.49%左右。经过人工胃液处理3h后,微胶囊中的活菌数可达8.79×109CFU/g,与理论预测值(8.85×109CFU/g)较为接近。表明实验所制备的微胶囊具有较好的耐酸性。
植物乳杆菌NCU116;微胶囊;人工胃液;响应面分析法
益生菌是与抗生素相对而言的概念,其定义为:通过改善肠内菌群平衡,对宿主起到有益作用的活性微生物[1]。经常服用益生菌,可预防和治疗腹泻,治疗轻度溃疡性结肠炎[2]。益生菌可以发酵乳糖生成更利于人体消化吸收的乳酸[3-4];水解人体消化不完全的蛋白质;增加可溶性钙、磷及某些B族维生素的含量[5-6]。益生菌及其代谢产物能促进人体消化酶的分泌和肠道的蠕动,进一步促进食物的消化吸收。研究证实,乳酸菌是一类对人体极为有利的益生菌[7-9]。随着人们对乳酸菌研究的深入,其特有的功能使得微生态制品和乳酸菌发酵产品的应用和发展受到食品行业的广泛关注。近年来,益生菌独特的营养与保健作用逐渐得到认可[10]。但是,目前绝大多数微生态活菌制剂存在着亟待解决的问题就是:由于益生菌的耐受性较差,活菌制剂进入消化道后多难以经受低pH值的胃酸、胆汁酸、消化酶等的作用,使之难以有足够的活菌数量到达肠道定殖并发挥作用,限制了益生菌生理作用的发挥。而采用微胶囊技术包埋益生菌,能增强菌体对外界环境的抵抗力,在肠道适当条件的作用下益生菌又可以释放出来,显着提高了菌体在到达肠道后的存活率[11]。
本实验通过人工模拟胃肠道环境,对微胶囊制备过程中的海藻酸钠质量浓度、脱脂乳质量浓度和氯化钙浓度进行单因素试验,并利用响应面设计进行优化以确定微胶囊制备的最佳工艺条件,以制备获得具有较好耐酸性的微胶囊。
1 材料与方法
1.1 菌种、培养基与试剂
植物乳杆菌NCU116由南昌大学食品科学与技术国家重点实验室保藏,MRS培养基[12-13]。
胃蛋白酶(酶活力1:10000) 美国Sigma公司;海藻酸钠、氯化钙、脱脂乳、柠檬酸钠。
1.2 仪器与设备
YXQ-LS-50SⅡ/75SⅡ立式压力蒸汽灭菌器 上海博迅实业有限公司医疗设备厂;Airtech生物安全柜 苏净集团安泰公司;DNP-9272型生化培养箱、DNP-9272型电热恒温培养箱 上海精宏实验设备有限公司;PB203-N型电子天平 梅特勒-托利多仪器(上海)有限公司;XSZ-4G型显微镜 重庆光电仪器有限公司;ZHWY-2102C型恒温培养振荡器 上海智城分析仪器制造有限公司;PHS-25型数显pH计 上海精密科学仪器有限公司。
1.3 人工胃液[14]
取质量浓度为0.1kg/L的盐酸16.4mL,加蒸馏水稀释,调节pH值至1.5。然后加入1g/100mL胃蛋白酶(100mL人工胃液中加入1g胃蛋白酶)计算,充分溶解后,用孔径0.20μm微孔滤膜过滤除菌,即得人工胃液。
1.4 方法
1.4.1 植物乳杆菌活菌计数
采用平板菌落计数法[15]。
1.4.2 菌种活化
将保存于4℃的植物乳杆菌菌种接入MRS液体培养基,37℃厌氧培养,进行活化处理。
1.4.3 植物乳杆菌生长曲线的测定
在MRS液体培养基中接入活化后的植物乳杆菌,37℃厌氧培养,每隔3h取样用0.85%生理盐水10倍稀释后测定活菌数。以培养时间为横坐标,对应的活菌数为纵坐标,绘制生长曲线,考察植物乳杆菌在MRS培养基中的生长特性。
1.4.4 微胶囊的制备
将培养所得的处于稳定期前期的植物乳杆菌经离心分离后,弃上清,将收集到的菌体制成菌悬液,加入脱脂乳作为壁材成分之一,静置一段时间,加入到冷却好的灭菌的海藻酸钠溶液中混合,搅拌均匀后,用玻璃注射器将混合液逐滴滴入冷却好的灭菌的一定浓度的氯化钙溶液中,固化一定时间,形成微胶囊,过滤取得样品,用清水漂去氯化钙残液,再用灭菌0.85%生理盐水洗涤微胶囊表面菌体,即得植物乳杆菌微胶囊。
1.4.5 微胶囊中菌体的释放
将制得的微胶囊溶于柠檬酸钠解囊液中,37℃条件下振荡使其完全崩解,以供计数。
1.4.6 微胶囊颗粒粒径的测定
随机取制得的微胶囊颗粒若干,分别用游标卡尺测量其粒径,取其平均值。
1.4.7 微胶囊包封率测定[16]
微胶囊溶液的活菌数:取微胶囊溶液,在4500r/min条件下离心10min,取出后去上清液,加入柠檬酸钠解囊液,37℃条件下振荡使其完全崩解,测活菌数。未包埋的活菌数:取微胶囊溶液,用滤网过滤,并用生理盐水冲洗,收集滤液,测活菌数(CFU/g)。

2 结果与分析
2.1 植物乳杆菌NCU116生长曲线

图1 植物乳杆菌NCU116生长曲线Fig.1 Growth curve of Lactobacillus plantarum NCU116
由图1可知,在0~6h,菌体处于延滞期,菌体数增长缓慢;6~12h,菌体进入旺盛的对数生长期,菌体数呈现几何型增长;12~21h,菌体进入稳定期;21h以后,菌体生长进入衰亡期。因此,在后续的实验当中,选定培养时间为18h的发酵液进行离心操作。
2.2 不同固化时间对微胶囊中植物乳杆菌活菌数的影响
制备微胶囊时,需要用氯化钙溶液进行固化,其时间的长短对微胶囊中包埋的活菌数会产生一定的影响,结果如图2所示。
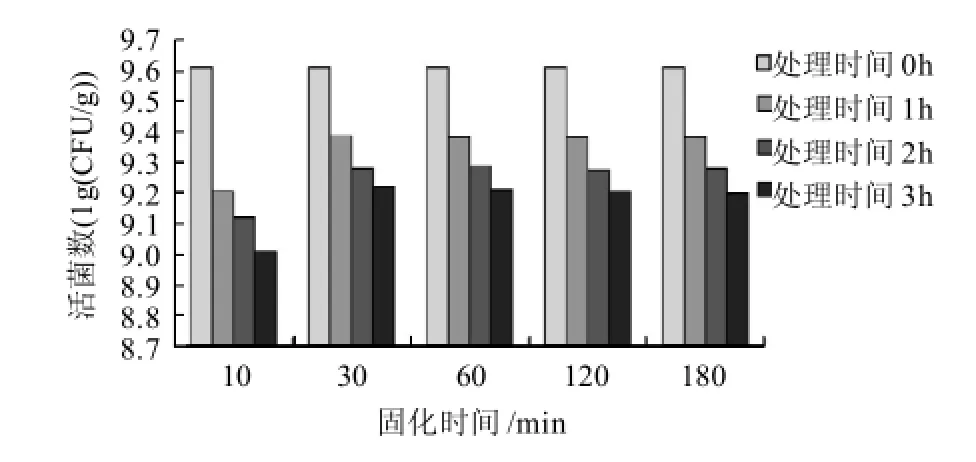
图2 不同固化时间对微胶囊植物乳杆菌活菌数的影响Fig.2 Effect of hardening time of capsule in calcium chloride onviability of encapsulated L. plantarum NCU116
由图2可知,固化30min后,经胃液处理后微胶囊中包埋的活菌数明显高于只固化10min的情况。这是因为微胶囊壁的厚度在固化的前15min快速增长,之后,凝胶厚度缓慢增长,最终达到最大值并稳定[17]。随着固化时间再延长,由于微胶囊壁厚已达到最大值,因此也不会提高其对胃液的耐受性。在后续的试验中,选择固化时间定为30~60min。
2.3 单因素试验
2.3.1 海藻酸钠质量浓度对微胶囊植物乳杆菌活菌数的影响
在脱脂乳质量浓度为4g/100mL,氯化钙浓度为0.2mol/L,海藻酸钠质量浓度为1、1.5、2、2.5、3g/100mL的条件下制备微胶囊。取微胶囊0.1g置于盛有50mL,pH1.5的人工胃液三角瓶中,于摇床中以37℃、180r/min处理,分别于0h和3h时取样测定其活菌数,确定最佳的海藻酸钠质量浓度,结果见图3。
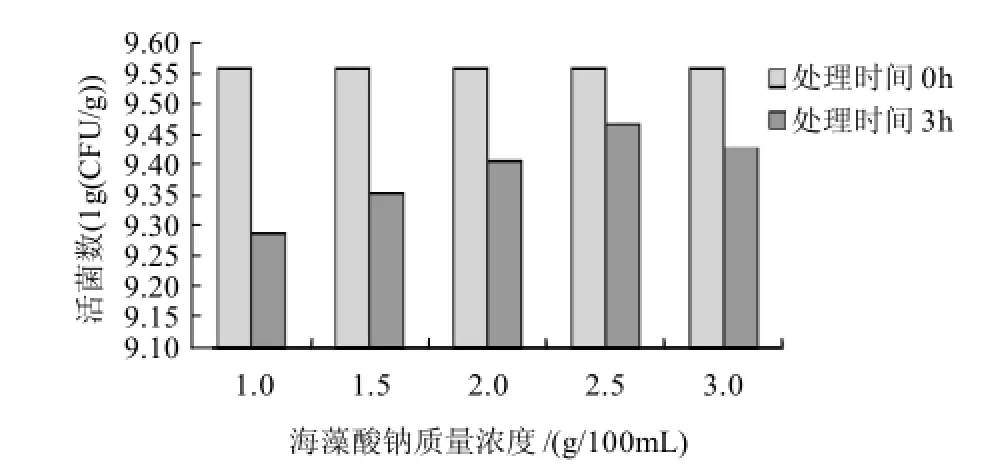
图3 海藻酸钠质量浓度对微胶囊植物乳杆菌活菌数的影响Fig.3 Effect of sodium alginate concentration on viability of encapsulated L. plantarum NCU116
由图3可知,海藻酸钠质量浓度为1g/100mL时形成的微胶囊经胃液处理后的活菌数最低,这是因为海藻酸钠质量浓度影响微胶囊机械强度,海藻酸钠质量浓度为1g/100mL条件下形成的微胶囊机械强度较低,囊壁较薄,对胃液的耐受性较弱。在其他条件不变的情况下,随着海藻酸钠质量浓度提高,微胶囊机械强度逐渐增大,且包埋的活菌数逐渐增多。当海藻酸钠质量浓度为2.5g/100mL时,微胶囊中包埋的活菌数最多。但当质量浓度提高到3g/100mL时,活菌数略有下降。可能是由于海藻酸钠质量浓度过高时,体系黏度也随之增大,不利于菌体分散到其中,使包埋效果降低。
2.3.2 氯化钙浓度对微胶囊植物乳杆菌活菌数的影响
在海藻酸钠质量浓度为2.5g/100mL,脱脂乳质量浓度为4g/100mL,氯化钙浓度分别为0.1、0.2、0.3、0.4、0.5mol/L的条件下制备微胶囊。取微胶囊0.1g置于盛有50mL、pH1.5的人工胃液三角瓶中,于摇床中以37℃、180r/min处理,分别于0、3h时取样测定其活菌数,确定最佳的氯化钙浓度,结果见图4。

图4 氯化钙浓度对微胶囊植物乳杆菌活菌数的影响Fig.4 Effect of calcium chloride concentration on viability of encapsulated L. plantarum NCU116
由图4可知,随着氯化钙浓度的增加,经胃液处理后微胶囊中包埋的活菌数也逐渐提高。原因是随着氯化钙溶液浓度的上升,溶液中可与海藻酸钠结合的Ca2+含量增加,故而形成了更致密的凝胶结构。氯化钙浓度为0.2mol/L时,微胶囊中包埋的活菌数最多,继续提高氯化钙的浓度,活菌数基本保持不变,这是因为微胶囊形成之后,所有Ca2+的结合位点已被占据,没有多余的空间提供给Ca2+[18],此时,随着氯化钙浓度的继续提高,微胶囊性能也不会发生变化,所以对胃液的耐受性保持不变。
2.3.3 脱脂乳质量浓度对微胶囊植物乳杆菌活菌数的影响
在海藻酸钠质量浓度为2.5g/100mL,氯化钙浓度为0.2mol/L,脱脂乳质量浓度分别为1、2、3、4、5g/100mL的条件下制备微胶囊。取微胶囊0.1g置于盛有50mL、pH1.5的人工胃液三角瓶中,于摇床中以37℃、180r/min处理,分别于0、3h时取样测定其活菌数,确定最佳的脱脂乳质量浓度,结果见图5。
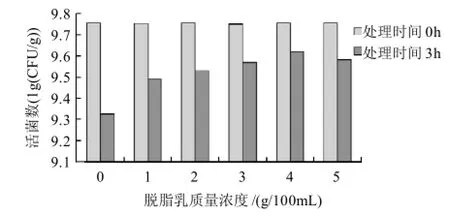
图5 脱脂乳质量浓度对微胶囊植物乳杆菌活菌数的影响Fig.5 Effect of skim milk concentration on viability of encapsulated L. plantarum NCU116
由图5可知,当不添加脱脂乳作为壁材成分时,经胃液处理后微胶囊中包埋的活菌数要远远低于添加脱脂乳之后的结果。当脱脂乳的质量浓度小于4g/100mL时,随着脱脂乳质量浓度的增加,经胃液处理后微胶囊中包埋的活菌数也随之增加。这是因为当pH值为1.5,且有胃蛋白酶存在的情况下,构成乳清蛋白主要成分的β-乳球蛋白的结构保持完整[19]。因此将脱脂乳作为壁材成分之一可以提高微胶囊对胃液的耐受性。但当脱脂乳的质量浓度达到5g/100mL时,活菌数略有下降。其原因可能是脱脂乳和海藻酸钠混合后使整个溶液的黏度增大,影响了微胶囊的包埋效果。
2.4 响应面设计优化
2.4.1 响应面试验结果
在单因素试验的基础上,以海藻酸钠质量浓度、氯化钙浓度,脱脂乳质量浓度为主要影响因素,由Box-Behnken设计方案,以经过胃液处理后微胶囊中的活菌数为响应值,利用响应面分析法对考察因素进行优化,确定较优的挤压制备工艺条件。结果见表1。
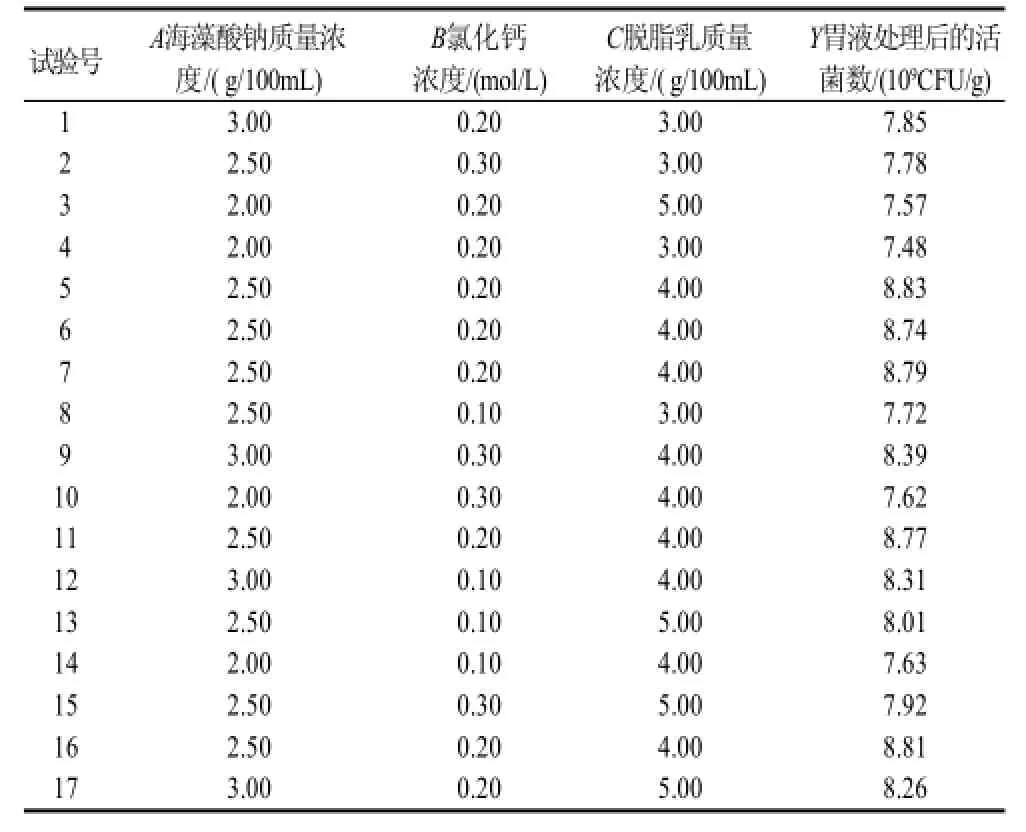
表1 Box-Behnken设计方案及响应值Table1 Box-Behnken design and results
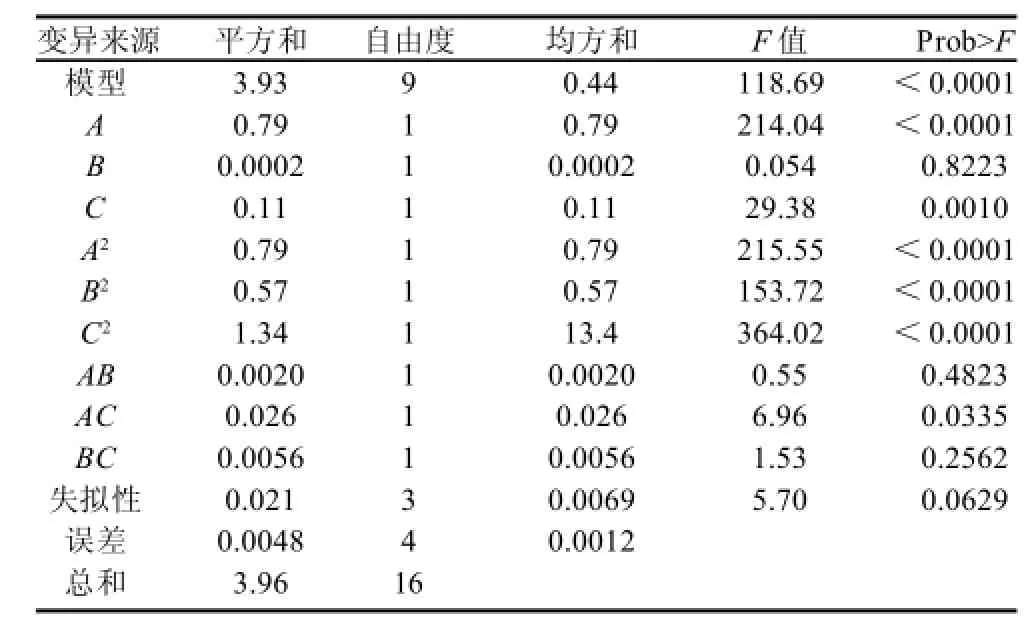
表2 回归方程方差分析Table2 Variance analysis of the established regression equation
经表1数据回归拟合后,得到以胃液处理后的活菌数为响应值的回归方程为:Y=8.79+0.31A+0.005B+0.12C-0.43A2-0.37B2-0.56C2-0.022AB+0.08AC-0.038BC。
经Design-Expert软件处理,回归方程方差分析结果如表2所示。海藻酸钠质量浓度对活菌数的影响极显着(P<0.0001),脱脂乳质量浓度的影响显着(P<0.05),但氯化钙浓度的影响不显着(P>0.05)。整体模型极显着(P<0.0001)。模型的失拟项相对于绝对误差是不显着的,而不显着的失拟项才可取。调整后的多元相关系数为R2Adj=0.9851,表明其应变量与全体自变量之间的多元回归关系显着,说明该回归方程对试验拟合程度较好,试验误差小,因此可以用该回归方程对活菌数的变化进行预测,并最终达到优化植物乳杆菌NCU116微胶囊制备工艺的目的。

图6 氯化钙浓度和海藻酸钠质量浓度对活菌数的影响Fig.6 Response surface plot showing the interaction effect of calcium chloride and sodium alginate concentrations on viability of encapsulated L. plantarum NCU116
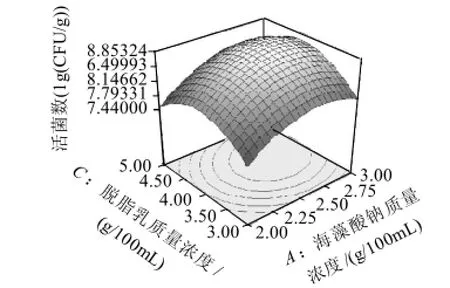
图7 脱脂乳质量浓度和海藻酸钠质量浓度对活菌数的影响Fig.7 Response surface plot showing the interaction effect of skim milk and sodium alginate concentrations on viability of encapsulated L. plantarum NCU116

图8 脱脂乳质量浓度和氯化钙浓度对活菌数的影响Fig.8 Response surface plot showing the interaction effect of skim milk and calcium chloride concentrations on viability of encapsulated L. plantarum NCU116
从图6~8上可形象地看出各因素交互作用对响应值的影响。图6显示,当氯化钙浓度一定时,活菌数随着海藻酸钠质量浓度的增加而呈现出先升高后降低的趋势,并在海藻酸钠质量浓度为2.70g/100mL,氯化钙浓度在0.20mol/L时,活菌数达到峰值;图7显示,固定海藻酸钠质量浓度,随着脱脂乳质量浓度的增加,活菌数呈现出先升高后降低的趋势,并在海藻酸钠质量浓度为2.70g/100mL,脱脂乳质量浓度为4.00g/100mL时,活菌数达到峰值;图8显示,当脱脂乳质量浓度一定时,随着氯化钙浓度的增加,活菌数呈现出先升高后降低的趋势,并在氯化钙浓度为0.23mol/L,脱脂乳质量浓度为4.20g/100mL时达到峰值。
2.4.2 微胶囊制备工艺条件的确定
通过回归模型预测的植物乳杆菌NCU116微胶囊制备的最佳工艺条件为:海藻酸钠质量浓度2.68g/100mL,氯化钙浓度0.20mol/L,脱脂乳质量浓度4.17g/100mL,在此条件下,经过胃液处理后,微胶囊中的活菌数理论上可达8.85×109CFU/g。
2.4.3 模型的验证
按照经优化后的工艺条件制备微胶囊,以进行验证实验。共进行3次实验,验证实验平均值为8.7 9× 109CFU/g,与模型预测值较为接近,说明模型能较好地反映微胶囊制备过程中的3个因素对于包埋活菌数的影响,从而证明通过该试验优化后得到的微胶囊制备工艺条件是真实可靠的。
3 结 论
以海藻酸钠和脱脂乳作为壁材,采用挤压法制备植物乳杆菌NCU116微胶囊,通过对微胶囊制备条件的优化,确定制备的最佳工艺条件为:海藻酸钠质量浓度2.68g/100mL,氯化钙浓度0.20mol/L,脱脂乳质量浓度4.17g/100mL。在此工艺条件下,可制得粒径为1.12mm的植物乳杆菌NCU116微胶囊,包封率在73.49%左右。经过人工胃液处理3h后,微胶囊中的活菌数可达8.79× 109CFU/g。表明实验所制备的微胶囊具有较好的耐酸性。微胶囊化处理可以有效地保护植物乳杆菌NCU116顺利地通过胃部环境,避免胃液的杀伤。
[1]曾子丹, 姚朔影. 益生菌的研究前景及国内外发展状况[J]. 食品工业科技, 2007, 28(8): 251-254.
[2]李雄彪, 崔云龙. 益生菌治疗溃疡性结肠炎及其作用机制[J]. 中华消化杂志, 2009(12): 855-857.
[3]VESA T H, MARTEAU P, KORPELA R. Lactose intolerance[J]. J Am Coll Nutr, 2000, 19(2): 165-175.
[4]周雨霞, 侯先志. 益生菌与肠道疾病[J]. 中国微生态学杂志, 2006, 18(2): 147-148.
[5]CLAUSEN M R, BONNEN H, TVEDE M, et al. Colonic fermentation to short-chain fatty acids is decreased in antibiotic-associated diarrhea[J]. Gastroenterology, 1991, 101(6): 1497-1504.
[6]李明华, 张大伟, 楚杰, 等. 益生菌的作用及其在食品中的应用[J].食品与药品, 2006, 8(8): 72-74.
[7]BRASHEARS M M, JARONI D, TRIMBLE J. Isolation, selection, and characterization of lactic acid bacteria for a competitive exclusion product to reduce shedding of Escherichia coli O157:H7 in cattle[J]. J Food Protection, 2003, 66(3): 355-363.
[8]LEE Y K, SALMINEN S. The coming of age of probiotics[J]. Trends in Food Sci & Technol, 1995, 6(7): 241-245.
[9]TANNOCK G W. Probiotic properties of lactic acid bacteria: plenty of scope for fundamental R&D[J]. Trends in Biotechnol, 1997, 15(7): 270-274.
[10]冯琼, 李保国, 张灼阳, 等. 静电喷雾法制备乳酸菌微胶囊的实验研究[J]. 中国微生态学杂志, 2008, 20(6): 544-546.
[11]ADHIKARI K, MUSTAPHA A, GRUN I U, et al. Viability of microencapsulated bifidobacteria in set yogurt during refrigerated storage[J]. J Dairy Sci, 2000, 83(9): 1946-1951.
[12]赵立彬, 刘凌, 童军茂, 等. 泡菜乳酸菌筛选鉴别及耐受性和促益生菌增殖的研究[J]. 食品与发酵工业, 2009, 35(10): 28-35.
[13]熊涛, 徐立荣, 范镭, 等. 蔬菜发酵专用乳酸菌的菌体高密度培养[J].食品科学, 2007, 28(12): 345-350.
[14]中华人民共和国卫生部. 中华人民共和国药典[M]. 广州: 广东科技出版社, 1995: 附录64.
[15]黄序, 戚蔽, 王建玲, 等. 肠溶性双歧杆菌微胶囊的初步研究[J]. 药物生物技术, 2002, 9(2): 105-109.
[16]冯琼, 李保国, 刘畅, 等. 静电喷雾法制备微胶囊化乳酸菌及其储存稳定性的研究[J]. 食品与发酵工业, 2009, 35(9): 54-57.
[17]BLANDINO A, MACIAS M, CANTERO D. Formation of calcium alginate gel capsules: influence of sodium alginate and calcium chloride concentration on gelation kinetics[J]. Journal of Bioscience and Bioengineering, 1999, 88(6): 686-689.
[18]CHANDRAMOULI V, KAILASAPATHY K, PEIRIS P, et al. An improved method of microencapsulation and its evaluation to protect Lactobacillus spp. in simulated gastric conditions[J]. Journal of Microbiological Methods, 2004, 56(1): 27-35.
[19]GBASSI G K, VANDAMME T, ENNAHAR S, et al. Microencapsulation of Lactobacillus plantarum spp. in an alginate matrix coated with whey proteins[J]. International Journal of Food Microbiology, 2009, 129(1): 103-105.
Optimization of Microencapsulation Process for Lactobacillus plantarum NCU116
XIONG Tao,FENG Chao,XIE Ming-yong
(State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China)
Beta-lactoglobulin, the main whey protein in bovine milk, has been shown to remain intact in the presence of pepsin and low pH. Skim milk was used as a coating material to improve microencapsulation of Lactobacillus plantarum NCU116 in calcium alginate beads. On the basis of single-factor experiments, the optimization of microencapsulation conditions was carried out using response surface analysis to maximize viable cell count in microcapsules after treatment with artificial gastric fluid. The results showed that the optimal encapsulation conditions were sodium alginate 2.68 g/100 mL, calcium chloride 0.20 mol/L, and skim milk 4.17 g/100 mL. Under these conditions, the particle size of microcapsules, encapsulation rate and viable cell count in microcapsules after treatment with artificial gastric fluid for 3 h were 1.12 mm, 73.49% and 8.79 × 109CFU/g (close to the theoretical value, 8.85 × 109CFU/g), respectively. Thus the microencapsulation conditions presented in this study could effectively protect Lactobacillus plantarum from adverse gastric conditions.
Lactobacillus plantarum NCU116;microencapsulation;simulated gastric fluid;response surface analysis
TS201.3
A
1002-6630(2012)01-0152-05
2011-02-24
食品科学与技术国家重点实验室目标导向项目(SKLF-MB-201003);教育部留学回国人员创业基金项目(赣教财字[2009]135号)
熊涛(1970—),男,教授,博士研究生,研究方向为益生菌及大宗果蔬高值化利用。E-mail:xiongtao0907@163.com



