陈林林,吴 春
(黑龙江省普通高等学校食品科学与工程重点实验室,哈尔滨商业大学食品工程学院,黑龙江 哈尔滨 150076)
菟丝子黄酮成分分析及对食用油脂的抗氧化活性
陈林林,吴 春
(黑龙江省普通高等学校食品科学与工程重点实验室,哈尔滨商业大学食品工程学院,黑龙江 哈尔滨 150076)
采用紫外光谱和高效液相色谱法,对菟丝子中主要黄酮成分,即芦丁、槲皮素、山奈酚进行定性、定量分析。以芦丁为标准品,紫外光谱测定菟丝子黄酮提取物,与芦丁标准品乙醇溶液相同,在300~380nm和240~280nm有两个吸收峰,可以确定提取物属于黄酮类化合物;采用高效液相色谱法准确的测定出3种黄酮成分的含量,且重现性好,说明该方法是可靠的。以过氧化值(POV)为指标,以猪油和花生油为介质研究菟丝子黄酮的抗氧化性能。结果表明:菟丝子黄酮对食用油脂有较强的抗氧化作用,且抗氧化效果与添加量有关;在猪油和花生油中,当菟丝子黄酮添加量分别达到0.08%和0.06%时抗氧化效果已高于0.02% BHT和0.01% PG。
菟丝子;黄酮;芦丁;抗氧化
菟丝子(Semen Cuscutae)为旋花科菟丝子属植物菟丝子(Cuscuta chinensisLam.)的种子[1-2],为寄生植物,具有清除氧自由基、扩张血管、改善脑循环、抑制血小板活化因子(PAF)等作用[3-4]。其主要化学成分为黄酮,且为重要的活性成分之一。黄酮类化合物广泛存在于自然界,是目前倍受关注的天然活性产物之一,泛指两个苯环(A环与B环)通过中央三碳链相互连接而成的一系列C6-C3-C6化合物,主要指以2-苯基色原酮为母核的化合物[5-7]。天然植物黄酮类物质在食品和医药工业上具有广泛的应用。菟丝子中的黄酮类化合物以槲皮素、芦丁及山奈酚为主[8-9]。本实验通过紫外光谱法确定提取物中黄酮类化合物的存在,采用高效液相色谱法对芦丁、槲皮素、山奈酚进行定性、定量的测定,并通过Schaal烘箱法测定菟丝子黄酮对食用油脂的抗氧化性能,以期为菟丝子黄酮在食品及药品中的有效利用提供一定的实验依据。
1 材料与方法
1.1 材料与试剂
菟丝子购于哈尔滨市宝丰药店;芦丁标准品(98%以上)中国医药集团上海化学试剂公司;槲皮素标准品(98.5%以上)、山奈酚标准品(98%以上) 上海同田生化试剂公司;大孔吸附树脂 南开大学化工厂;无水乙醇、氯仿、乙酸乙酯、磷酸均为分析纯试剂;甲醇为优级醇。
1.2 仪器与设备
FZ102型植物粉碎机 天津市泰斯特仪器有限公司;PC-1000数显示恒温水浴锅 上海精密仪器仪表有限公司;R-201旋转蒸发仪 上海申胜生物技术有限公司;UV-190型紫外光谱仪 日本岛津公司;高压液相色谱仪、2487紫外检测器 美国Waters公司;XDB-C18色谱柱(4.6mm×150mm,5μm) 美国安捷伦公司。
1.3 方法
1.3.1 菟丝子总黄酮的提取纯化
将菟丝子粉碎过筛后经石油醚脱脂,准确称取处理过的菟丝子10g于250mL三角瓶中,在固液比为1:16(m/V)、75℃条件下用体积分数70%乙醇提取2h,取出过滤,将滤渣二次浸提后过滤,合并两次所得滤液,将其采用H-103型大孔吸附树脂进行纯化,通过减压浓缩、真空干燥后即得菟丝子黄酮[10-12]。
1.3.2 菟丝子总黄酮含量的测定
标准曲线绘制:准确称取芦丁(105℃干燥至恒质量)0.0794g于100mL烧杯中,用体积分数30%乙醇溶解后转移至250mL容量瓶中,定容至刻度,配成0.3176g/L的标准溶液。标准曲线的绘制根据文献[13],得芦丁质量浓度(y,mg/mL)与吸光度(x)之间的回归方程为:y=0.11530.00108,R2=0.9998。
取1mL 定容后的提取液于25mL容量瓶中,其余步骤与标准曲线的制作方法相同。
1.3.3 菟丝子黄酮紫外光谱检测
将0.5mg/mL的芦丁标准溶液和0.5mg/mL纯化后的菟丝子黄酮溶液,在波长为190~500nm范围内进行扫描,通过与芦丁标准溶液的光谱图作对比,确定提取液中黄酮类物质的存在[14]。
1.3.4 菟丝子黄酮高效液相色谱检测
分别将纯化后的菟丝子黄酮和柱层析收集的各组分10mg用色谱甲醇溶解,经0.45μm滤膜过滤后,移入50mL容量瓶中,用甲醇定容[15]。同时用甲醇配制含有芦丁、槲皮素、山奈酚的混合标准溶液,质量浓度分别为0.132、0.140、0.072mg/mL。
分别精密量取2、4、6、8、10μL的混合标准溶液进样,通过3种标准品的峰面积,确定各自关于质量浓度与峰面积的标准曲线。再分别精密量取待测物进样,与标准品的保留时间相对照进行待测样的定性;通过标准溶液的含量,以峰面积外标法计算含量。
液相色谱条件为:C18色谱柱,YGW预柱,流动相为磷酸-甲醇(体积比1:1),流量1.5mL/min,进样量10μL,检测波长360nm。
1.3.5 菟丝子黄酮对食用油脂抗氧化性能的测定
采用Schaal烘箱法:取50g油样,放入100mL烧杯中,敞口,分别将菟丝子黄酮、2,6-二叔丁基-4-甲基苯酚(BHT)和没食子酸丙酯(PG)等按一定比例加入油样中,搅拌,使其充分溶解,同时设置空白对照组。然后将油样放入60℃鼓风烘箱中强化保存,每隔24h搅拌一次,并交换它们在烘箱中的位置。根据国家标准GB/T 5009.37-1996《食用植物油卫生标准的分析方法》定期测定油样的过氧化值(POV)[16-17]。
根据食用油脂卫生标准规定,油脂中POV达到11.8meq/kg时所需时间为诱导时间,即AOM值。通过计算方程lnc=-kt+lnc0(c为POV/(meq/kg);k为速率常数;t为时间/d;c0为油脂起始POV/(meq/kg))得到AOM值。保护系数(PF)要通过诱导时间来计算,见以下公式。

2 结果与分析
2.1 菟丝子黄酮的紫外光谱分析
黄酮类化合物具有羰基与两芳香环形成较强的共轭体系,其在乙醇中的紫外吸收光谱由两个主要吸收带组成:出现在300~380nm,为B环肉桂酰的吸收;出现在240~280nm,为A环的苯甲酰结构。因此可根据这两个吸收峰初步判断黄酮类化合物的存在。
选择芦丁标准品的紫外光谱与提取液的紫外光谱进行比较,确定菟丝子提取液中黄酮类物质的存在,结果见图1。
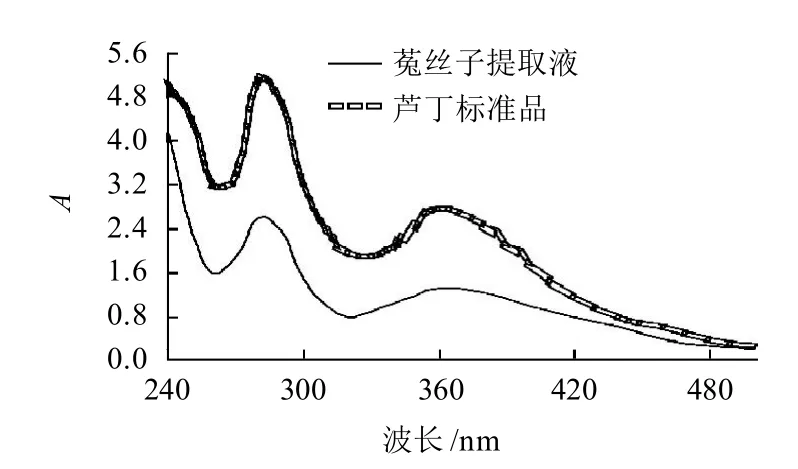
图1 芦丁标准品与菟丝子提取液的紫外吸收光谱Fig.1 UV absorption spectra of rutin standard and the extract of Semen Cuscutae
由图1可知,提取液与芦丁标准品一样,在320~380nm和260~280nm有两个吸收峰,可以确定提取液属于黄酮类化合物。但是提取液在320~380nm波长处的峰形不显着,原因是与提取物中存在不同的黄酮类物质导致峰的叠加有关。
2.2 菟丝子黄酮的高效液相色谱分析

图2 混合标准品HPLC谱图Fig.2 HPLC chromatogram of mixed standards
将图2中各色谱峰面积与标准品质量浓度求回归方程,以峰面积为纵坐标,以质量浓度横坐标分别做芦丁、槲皮素、山奈酚的标准曲线为:y=11608x+49772,R2=0.9996,线性范围为13~132μg/mL;y=12571x+40348,R2=0.9997,线性范围为14~140μg/mL;y=29831x+35615,R2=0.9997,线性范围为7~70μg/mL。
将菟丝子黄酮(图3)与混合标准品的HPLC谱图作对照,菟丝子黄酮含有的芦丁、槲皮素、山奈酚与标准品在相同的保留时间出峰,定性的说明这3种成分的存在。同时可以根据混合标准品通过液相得出的含量与峰面积的标准曲线,确定这3种成分的含量分别为:0.179、0.162、0.158mg/mL。

图3 菟丝子黄酮HPLC谱图Fig.3 HPLC chromatogram of flavonoids from Semen Cuscutae
按样品测定方法,对样品进行5次平行实验,结果得RSD为1.85%,说明本法的重现性良好。
2.3 菟丝子黄酮对食用油脂的抗氧化性能
2.3.1 对猪油的抗氧化作用
将菟丝子黄酮以不同的比例加入至50g猪油中,按照Schaal烘箱法,定期测定POV,结果见表1。空白样品的POV从第8天开始急剧增大,菟丝子黄酮的添加量小于0.04%时,随时间的延长,POV增大较快,但仍小于空白样;当菟丝子黄酮的添加量达到0.08%时POV的变化幅度已经小于0.02% BHT和0.01% PG;菟丝子黄酮添加量为0.10%的实验组在20d内POV变化最平缓,说明其抗氧化效果是最佳的。添加抗氧化剂的猪油样品的诱导时间均大于空白样品的诱导时间。每组添加量菟丝子黄酮的保护系数均大于1,说明该物质对猪油具有抗氧化作用,且随着添加量的增加,其对猪油的抗氧化作用增强。菟丝子黄酮的添加量达到0.06%时,即具有明显的抗氧化活性(PF>2);当添加量达到0.08%时,其抗氧化能力已大于0.02%BHT或0.01% PG。

表1 菟丝子黄酮与合成抗氧化剂对猪油抗氧化作用的比较Table 1 Antioxidant effects of flavonoids from Semen Cuscutae and synthetic antioxidants on lard
2.3.2 对花生油的抗氧化作用
将菟丝子黄酮以不同的比例加入至50g花生油中,按照Schaal烘箱法,定期测定POV,结果见表2。

表2 菟丝子黄酮与合成抗氧化剂对花生油的抗氧化作用比较Table 2 Antioxidant effects of flavonoids from Semen Cuscutae and synthetic antioxidants on peanut oil
由表2可知,空白样品的POV从第4天开始明显增大,菟丝子黄酮的添加量大于0.02%时,随时间的延长,POV增大趋势缓慢;当菟丝子黄酮的添加量达到0.06%以上时POV的变化趋势平缓。添加抗氧化剂的花生油样品的AOM值均大于空白样品的AOM值。每组添加量菟丝子黄酮的保护系数均大于1,说明该物质对花生油具有抗氧化作用。且随着添加量的增加,其对花生油的抗氧化作用增强。菟丝子黄酮的添加量达到0.06%时,即具有明显的抗氧化活性(PF>2),且其抗氧化能力已大于0.02%BHT或0.01%PG。菟丝子黄酮在添加量为0.01%~0.1%范围内的POV均比在猪油中小,说明其对花生油的抗氧化效果好于猪油。
3 结 论
根据以上的结果与分析可知,采用紫外光谱和高效液相色谱法,对菟丝子中3种黄酮成分,即芦丁、槲皮素、山奈酚进行的定性、定量测定,得到的分析结果可靠性高。确定了菟丝子中黄酮类化合物的存在及其含有的3种成分的含量。通过考察菟丝子黄酮对食用油脂的抗氧化作用,确定当菟丝子黄酮添加量分别为0.08%和0.06%时,其对猪油和花生油的抗氧化活性好于0.02% BHT或0.01% PG抗氧化剂,说明菟丝子黄酮更具实际应用性。
[1] 郭洪祝, 李家实. 南方菟丝子黄酮类成分的研究[J]. 中国中药杂志,1997, 22(1): 38-39.
[2] 张崇高. 我国菟丝子研究概况[J]. 杂草科学, 2003, 1(1): 1-4.
[3] 张晓鹤. 菟丝子的研究进展[J]. 天津药学, 2004, 16(2): 43-45.
[4] 叶敏, 阎玉凝. 菟丝子药理研究进展[J]. 北京中医药大学学报, 2000,23(9): 52-53.
[5] 钟秋平, 林美芳. 黄皮果中总黄酮含量的测定及其黄酮种类的鉴别[J]. 食品科学, 2007, 28(8): 411-413.
[6] 张鞍灵, 高锦明, 王姝清. 黄酮类化合物的分布及开发利用[J]. 西北林学院学报, 2000, 15(1): 69-74.
[7] SEO H J, SURH Y J. Eupatilin, a pharmacologically active flavone derived fromArtemisiaplants, induces apoptosis in human promyelocytic leukemia cells[J]. J Mutation Research, 2001, 496(2): 191- 198.
[8] 叶敏, 阎玉凝, 乔梁, 等. 中药菟丝子化学成分研究[J]. 中国中药杂志, 2002, 27(2): 115-117.
[9] 刘利萍, 刘健, 陈海丰. 中药菟丝子的研究进展[J]. 中药材, 2001, 24(11): 839-843.
[10] 宋小妹, 张培芳. 银杏叶总黄酮提取分离工艺研究[J]. 山西中医药学院学报, 1998, 21(2): 34-36.
[11] 赵翾, 李红良, 张惠妹. 响应面法优化火麻仁黄酮提取工艺[J]. 食品科学, 2011, 32(2): 127-131.
[12] 彭游, 叶志刚, 邓泽元. 沙棘黄酮光波干法辅助提取及其机理研究[J]. 食品科技, 2011, 36(4): 197-200.
[13] 李维莉, 马银海, 彭永芳. 蜂胶黄酮提取方法研究[J]. 食品科学, 2003,24(5): 100-101
[14] 潘见, 骆祥峰, 王国霞. 紫外分光光度法测银杏黄酮苷含量误差分析[J]. 合肥工业大学学报, 2000, 23(4): 464-467.
[15] YE Min, LI Yan. Determination of flavonoids in semen cuscutae by RPHPLC[J]. J Pharm and Bio Analysis, 2002, 28(4): 621-628.
[16] 刘书成, 李元瑞, 王丽华, 等. 大蒜精油对食用油脂的抗氧化特性[J].食品科学, 2002, 23(1): 128-131.
[17] 张德海, 杨晓泉. 柚皮提取物的抗氧化作用研究[J]. 中国油脂, 2001,26(4): 54-57.
Composition Analysis of Flavonoids fromSemen Cuscutaeand Antioxidant Activity in Edible Oil and Fat
CHEN Lin-lin,WU Chun
(Key Laboratory for Food Science and Engineering, College of Food Engineering,Harbin University of Commerce, Harbin 150076, China)
Flavonoids fromSemen Cuscutaeincluding rutin, quercetin and kaemperferol were determined qualitatively and quantitatively by ultraviolet spectroscopy and high performance liquid chromatography (HPLC). Using rutin as standard substance, flavonoid extract ofSemen Cuscutaewas determined and found to show two absorption peaks in the range of 300—380 nm and 240—280 nm. The contents of three flavonoid components were determined accurately by HPLC with repeatable results. Flavonoids fromSemen Cuscutaedisplayed strong antioxidant activity in lard and peanut oil in a dose-dependent manner as evaluated based on peroxide value. In both matrices, the antioxidant effect at doses of 0.08% and 0.06% was superior to that of 0.02% BHT and 0.01% PG.
Semen Cuscutae;flavonoids;rutin;antioxidant activity
TS218
A
1002-6630(2012)15-0103-04
2011-06-30
黑龙江省自然科学基金项目(B201001) ;黑龙江省高校科技创新团队建设计划资助项目(2010td04)
陈林林(1979—),女,讲师,博士,研究方向为食品科学。E-mail:linclear1207@yahoo.com.cn



