李芬芬,黄丹菲,江乐明,谢明勇
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
大粒车前子多糖对脂多糖刺激RAW264.7巨噬细胞的免疫调节作用
李芬芬,黄丹菲,江乐明,谢明勇*
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
采用脂多糖构建RAW264.7巨噬细胞炎症模型,研究大粒车前子多糖的抗炎作用。培养巨噬细胞RAW264.7,利用脂多糖构建细胞炎症模型,中性红吞噬实验检测细胞吞噬活性;酶联免疫吸附法检测车前子精制多糖(Plantago asiat ica L. crude polysaccharide,PLCP)处理前后细胞上清液中肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-10(interleukin-10,IL-10)和IL-6的分泌量,Griess反应测定RAW264.7细胞释放NO水平。结果表明,PLCP可显着抑制RAW264.7炎症细胞的吞噬活性,降低炎症细胞因子TNF-α、IL-10和IL-6的分泌量及NO的释放量。
大粒车前子;多糖;RAW264.7巨噬细胞;炎症;抗炎
车前子为大粒车前(Plantago asiatica L.)或平车前(Plantago depressa Willd.)的干燥成熟种子[1],其种皮含有大量的黏液质,是由阿拉伯糖、木糖、甘露糖和半乳糖构成的杂多糖[2],具有整肠通便[3]、降低血脂、调节血糖[4]、免疫调节[5-6]及抗氧化清除自由基[7]等功能,但有关其在抗炎方面的研究并不多,而其产生抗炎作用的分子生物学机制也还不明确。
炎症是机体的防御性反应,通常对机体是有利的,但过度的炎症反应会导致体内释放过多的炎症性介质,引起局部或全身的炎症性反应[8]。巨噬细胞是机体重要的免疫调节及效应细胞,参与机体的大多数免疫反应,它能清除衰老的宿主细胞和分子,在机体抵御感染的过程中也起到重要的作用[9],是炎症过程的关键角色之一,主要体现在炎症部位高浓度趋化因子诱导巨噬细胞活化并向感染部位募集,活化的巨噬细胞进一步分泌白细胞介素-8(interleukin-8,IL-8)等趋化因子,诱导更多的巨噬细胞活化募集,释放IL-6等促炎症因子及前列腺素等炎症介质,诱导和加强局部炎症反应[10-11]。本实验拟通过脂多糖(lipopolyssacharide,LPS)刺激小鼠巨噬细胞RAW264.7建立炎症细胞模型,探讨车前子多糖对巨噬细胞的抗炎作用,不仅为深入研究车前子抗炎活性物质及其作用机制提供实验基础,也为开发大粒车前子资源提供理论依据。
1 材料与方法
1.1 材料与试剂
大粒车前子产自江西吉安;RAW264.7细胞系购自上海细胞生物研究所。
RPMI 1640培养基 美国Gibco公司;胎牛血清(fetal bovine serum,FBS)、磷酸盐缓冲液(phosphate buffered saline,PBS)、L-谷氨酰胺、β-二巯基乙醇、二甲基亚砜、青霉素、链霉素 美国HyClone公司;Griess检测试剂盒 南京建成生物工程研究所;LPS 美国Sigma公司;肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)酶联免疫吸附(enzyme-linked immunosorbent assay,ELISA)试剂盒、白细胞介素-10(interleukin-10,IL-10)ELISA试剂盒、IL-6 ELISA试剂盒 武汉博士德公司;中性红 温州市化学试剂有限公司。
1.2 仪器与设备
3K15-高速冷冻离心机 德国Sigma公司;酶标仪美国Bio-Rad公司;CO2培养箱 美国Thermo公司;倒置显微镜 日本Olympus公司。
1.3 方法
1.3.1 大粒车前子多糖的提取与纯化
采用水提醇沉法从大粒车前子中提取多糖成分,优化的提取条件为:大粒车前子粉末与水(1∶10,m/V)在100 ℃下提取3 h,重复2 次。将提取液合并浓缩,80%乙醇沉淀过夜。4 800 r/min离心10 min收集多糖沉淀,并依次用丙酮、无水乙醚和无水乙醇各洗涤2 次,干燥得车前子多糖,得率约为10.0%。采用Sevag法对车前子多糖进行脱蛋白处理制备得到精制车前子多糖(Plantago asiatica L. crude polysaccharide,PLCP)[7]。
1.3.2 细胞培养与模型建立
用含体积分数10%胎牛血清、100 U/mL青霉素及100 U/mL链霉素的RPMI 1640培养基培养(37 ℃、5% CO2)RAW264.7巨噬细胞并对其进行分组。空白对照组:不用LPS处理也不加多糖干预;模型对照组:加入10 mg/L的LPS干预;实验组:10 mg/L的LPS干预,并用PLCP(PLCP终质量浓度分别为20、40、80、160 μg/mL)处理。
1.3.3 细胞吞噬活性 测定
调节RAW264.7巨噬细胞密度为5×105个/mL,以每孔100 μL接种于96 孔板,置于培养箱(37 ℃、5% CO2)培养3 h后洗去未贴壁细胞。每孔加入100 μL含10%胎牛血清的RPMI 1640培养基,各组按相应处理加入LPS、PLCP进行培养。24 h后每孔加入含中性红(体积分数0.1%)的生理盐水溶液100 μL,继续培养4 h,弃去上清液,用PBS洗3 遍,每孔加入细胞溶解液(V(冰醋酸)∶V(乙醇)=1∶1)100 μL,4 ℃条件下放置2~3 h,待细胞溶解后在酶标仪上测定540 nm波长处的光密度值。
1.3.4 NO分泌水平测定
采用Griess法对NO-2定量间接检测NO生成。RAW264.7巨噬细胞接种于96 孔培养板,各组细胞在不同处理因素作用24 h后,每孔取细胞培养液50 μL,用Griess试剂测试,酶标仪550 nm波长处测定吸光度。根据NaNO2制得的标准曲线计算培养基中NO的生成量。
1.3.5 细胞因子分泌水平测定
取RAW264.7巨噬细胞接种于24 孔细胞培养板中,不同组别按照相应处理培养24 h后,取上清液进行测定。TNF-α、IL-10和IL-6水平的测定按照ELISA试剂盒说明书进行。
1.4 数据分析
2 结果与分析
2.1 PLCP对LPS刺激RAW264.7细胞吞噬活性的影响
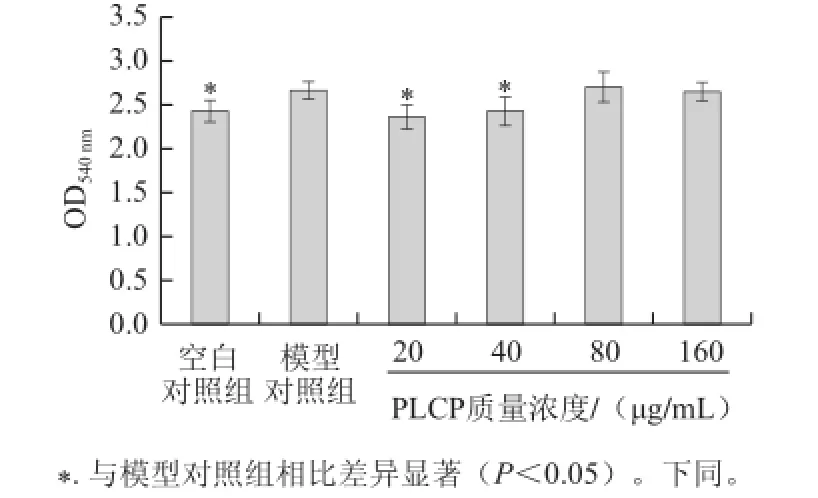
图1 PLCP对LPS刺激的RAW264.7细胞中性红吞噬活性的影响Fig.1 Inhibitory effect of PLCP on the phagocytosis of LPS-stimulated RAW264.7 cells
如图1所示,与模型对照组相比,PLCP在低质量浓度范围内(20、40 μg/mL)对LPS激活的RAW264.7细胞的吞噬活性具有显着抑制作用(P<0.05)。
2.2 PLCP对LPS刺激RAW264.7细胞释放NO的影响
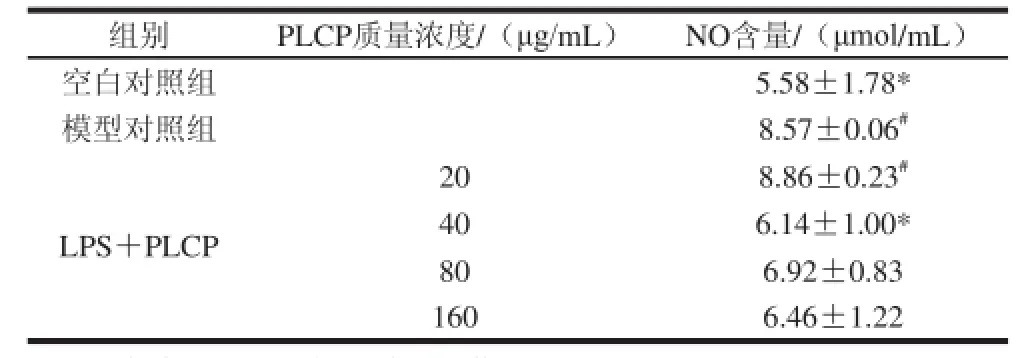
表1 PLCP对LPS刺激的RAW264.7细胞NO分泌水平的影响Table1 Inhibitory effect of PLCP on NO production in mouse macrophage cell line RAW264.7
由表1可知,和空白对照组相比,模型对照组释放大量NO(P<0.05),PLCP作用于LPS刺激的RAW264.7细胞后,NO分泌量下降,PLCP质量浓度为40 μg/mL时对细胞分泌NO活性的抑制效果最为显着(P<0.05)。
2.3 PLCP对LPS刺激RAW264.7细胞分泌炎症细胞因子的影响

表2 PLCP对LPS刺激RAW264.7细胞分泌TNF--α、IL-6和IL--10水平的影响Table2 Inhibitory effect of PLCP on TNF-α, IL-6 and IL-10 production in LPS-stimulated RAW264.7 cellss
由表2可知,PLCP对LPS刺激RAW264.7细胞分泌炎症细胞因子有显着影响。和模型对照组相比,在40~160 μg/mL范围内,PLCP能够明显抑制LPS刺激RAW264.7细胞分泌TNF-α和IL-6,在20~160 μg/mL范围内可显着抑制LPS刺激RAW264.7细胞分泌IL-10,且呈剂量依赖关系。
3 讨 论
炎症反应是一种重要的机体防御过程,涉及机体活动的许多环节,其中免疫细胞(巨噬细胞、中性粒细胞等)的激活是炎症反应的启动环节[13]。巨噬细胞是炎症反应的重要效应细胞,RAW264.7细胞作为巨噬细胞的一种,可激活机体的免疫系统,当机体受LPS等外界因素刺激后,能够促进机体产生炎症介质,发挥免疫功能[14]。许多研究发现多糖能调节巨噬细胞的功能,并揭示了多糖与其表面受体及信号转导通路相关的作用机理[15]。因此本实验以LPS刺激RAW264.7细胞为模型,探讨PLCP对巨噬细胞的抗炎作用。
巨噬细胞是一种主要的专职吞噬细胞,是机体的清道夫,可以通过其表面受体识别并吞噬入侵机体的病原菌及本身衰老和死亡的细胞,从而提高机体机能[16]。中性红吞噬实验显示,低质量浓度的PLCP能够抑制RAW264.7细胞的吞噬活性,说明PLCP可调节炎症反应,并且低质量浓度的PLCP能有效地防止巨噬细胞的过度活化。
LPS刺激后的巨噬细胞可大量表达诱导型一氧化氮合成酶(inducible nitric oxide synthase,iNOS)并分泌大量的NO。NO作为体内重要的信使和效应分子,对细菌等病原体具有杀伤和细胞毒性作用[17],从而介导炎症反应。但NO的过量释放会损伤正常的细胞,引起过度炎症反应。研究发现NO对细菌感染、创伤等均具有很好的疗效[18]。巨噬细胞NO的合成、分泌与细胞因子有着相互调节作用[19]。当PLCP质量浓度在40~160 μg/mL时,能下调RAW264.7细胞释放NO,这可能与抑制巨噬细胞的活化、减少与iNOS表达相关炎症因子的释放有关。
免疫细胞产生的许多细胞因子参与免疫系统的调节,而植物多糖对细胞因子以及受体表达的影响是其发挥抗炎作用的重要分子机制。TNF-α是巨噬细胞在炎症反应中产生的主要促炎细胞因子,可调节细胞的生长分化、增殖,调节免疫应答,以正反馈调控的形式参与许多炎症反应,具有重要的生物功能[20]。因此,本实验测定了PLCP对LPS刺激RAW264.7细胞分泌TNF-α的影响,结果发现PLCP在40~ 160 μg/mL范围内可显着抑制RAW264.7细胞分泌TNF-α,且具有一定的剂量依赖性。由此可以说明PLCP可能通过下调TNF-α的表达参与抗炎反应。IL-10是一种可由活化的单核-巨噬细胞产生的多功能抗炎细胞因子,可调节多种免疫细胞的功能[21-22],通过负反馈调节发挥抗炎作用[23]。本实验发现在实验剂量范围内PLCP均可显着抑制IL-10的释放,并符合剂量依赖关系。IL-6在先天性免疫和获得性免疫中都具有突出的贡献[24],可调控T淋巴细胞的分化和激活,诱导辅助T细胞的活化,维持调节性T细胞和辅助性T细胞间的平衡,在慢性炎症中发 挥了重要作用[25]。本实验发现在40~160 μg/mL范围内PLCP可显着下调LPS刺激RAW264.7细胞分泌IL-6。以上结果表明,PLCP的抗炎作用可能与抑制细胞因子的表达,保持TNF-α、IL-10和IL-6之间的平衡有关。
综上所述,PLCP可通过抑制LPS刺激巨噬细胞的吞噬作用、NO的释放及细胞因子的表达发挥其抗炎作用,其具体的抗炎作用机制还有待进一步研究。
[1] 国家药典委员会. 中华人民共和国药典(一部)[M]. 北京: 中国医药科技出版社, 2010: 63.
[2] YIN Junyi, LIN Huixia, LI Jing, et al. Structural characterization of a highly branched polysaccharide from the seeds of Plantago asiatica L.[J]. Carbohydrate Polymers, 2012, 87(4): 2416-2424.
[3] MARLETT J A, FISCHER M H. A poorly fermented gel from psyllium seed husk increases excreta moisture and bile acid excretion in rats[J]. Journal of Nutrition, 2002, 132(9): 2638-2643.
[4] ANDERSON J W, ALLGOOD L D, TURNER J, et al. Effects of psyllium on glucose and serum lipid responses in men with type 2 diabetes and hypercholesterolemia[J]. American Journal of Clinical Nut rition, 1999, 70(4): 466-473.
[5] HUANG Danfei, TANG Yongfu, NIE Shaoping, et al. Effect of phenylethanoid glycosides and polysaccharides from the seed of Plantago asiatica L. on the maturation of muri ne bone marrow-derived dendritic cells[J]. European Journal of Pharmacology, 2009, 620(1/3): 105-111.
[6] HUANG Danfei, XIE Mingyong, YIN Junyi, et al. Imm unomodulatoryactivity of the seeds of Plantago asiatica L.[J]. Journal of Ethnopharmacology, 2009, 124(3): 493-498.
[7] YE Chunlin, HU Weilian, DAI Dehui. Extraction of polysaccharides and the antioxidant activity fr om the seeds of Plantago asiatica L.[J]. International Journal of Biological Macromolecules, 2011, 49(4): 466-470.
[8] SCHEPETKIN I A, QUINN M T. Botanical polysaccharides: macrophage immunomodulat ion and therapeutic potential[J]. International Immunopharmacology, 2006, 6(3): 317-333.
[9] GORDON S. Pattern recognition receptors: doubling up for the innate immune respons e[J]. Cell, 2002, 111(7): 927-930.
[10] 杨一新, 李桂源. LPS所介导的信号转导通路研究进展[J]. 中南大学学报: 医学版, 2006, 31(1): 141-145.
[11] MARTINEZ F O, SICA A, MANTOVANI A, et al. Macrophage activation and polarization[J]. Frontiers in Bioscience, 2008, 13: 453- 461.
[12] MOSMANN T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays[J]. Journal of Immunological Methods, 1983, 65(1): 55-63.
[13] 庞然, 张淑玲, 赵雷, 等. 草木犀正丁醇提取物对小鼠巨噬细胞促炎介质的影响[J]. 中国现代医学杂志, 2009, 19(19): 2893-2896.
[14] RHULE A, NAVARRO S, SMITH J R, et al. Panax notoginseng attenuates LPS-induced pro-inflammatory mediators in RAW264.7 cells[J]. Journal of Ethnopharmacology, 2006, 106(1): 121-128.
[15] 荣岳光, 佟建明. 多糖对巨噬细胞功能影响的研究进展[J]. 中国畜牧兽医, 2007, 34(5): 9-13.
[16] 叶莎莎, 曾耀英, 尹乐乐. 红景天苷对小鼠腹腔巨噬细胞体外增殖、凋亡、吞噬、ROS和NO产生的影响[J]. 细胞与分子免疫学杂志, 2011, 27(3): 237-241.
[17] 吕梦捷, 曾耀英, 宋兵. 人参皂甙Rb1对小鼠腹腔巨噬细胞体外吞噬及 细胞因子和NO分泌的影响[J]. 细胞与分子免疫学杂志, 2011, 27(3): 242-244.
[18] CARPENTER A W, SCHOENFISCH M H. Nitric oxide release: Part II. Therapeutic applications[J]. Chemical Society Review s, 2012, 41(10): 3742-3752.
[19] 杨光, 李鸣真. 一氧化氮与炎症及免疫调节[J]. 国外医学: 免疫学分册, 1995, 18(6): 303-307.
[20] TOUSSIROT E, WENDING D. The use of TNF-α blocking agents in rheumatoid arthritis: an update[J]. Expert Opin Pharmacother, 2007, 8(13): 2089-2107.
[21] ULUIŞIK D, KESKI N E. The effects of ginseng and echinacea on some plasma cytokine levels in rats[J]. Kafkas Universitesi Veteriner Fakultesi Dergisi, 2012, 18(1): 65-68.
[22] LIANG Guang, ZHOU Huiping, WANG Yi, et al. Inhibition of LPS-induced production of inflammatory factors in the macrophages by mono-carbonyl analogues of curcumin[J]. Journal of Cellular and Molecular Medicine, 2009, 13(9b): 3370-3379.
[23] 舒旷 怡, 张颖, 杨锦红, 等. LBP对LPS刺激巨噬细胞分泌细胞因子的调节作用[J]. 解放军医学杂志, 2010, 35(8): 937-941.
[24] JONES S A. Directing transition from innate to acquired immunity: def ning a role for IL-6[J]. The Journal of Immunology, 2005, 175(6): 3463-3468.
[25] ALCIATO F, SAINAGHI P P, SOLA D, et al. TNF-α, IL-6, and IL-1 expression is inhibited by GAS6 in monocytes/macrophages[J]. Journal of Leukocyte Biology, 2010, 87(5): 869-875.
Immunoregulatory Effect of Polysaccharide from the Seeds of Plant ago asiatica L. on RAW264.7 Cells Stimulated with Lipopolysaccharide
LI Fen-fen, HUANG Dan-fei, JIANG Le-ming, XIE Ming-yong*
(State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China)
To study the immunoregulatory effect of polysaccharide from the seeds of Plantago asiatica L. on RAW264.7 cells, a model of inf ammation stimulated with lipopolysaccharide (LPS) was established. The phagocytic activity of the cells was observed by neutral red phagocy tosis experiments. At the same time, the levels of TNF-α, IL-10 and IL-6 in the cultural supernatant were quantif ed before and after addition of crude polysaccharide from Plantago asiatica L. (PLCP) by ELISA. In addition, the expression of NO which was suppressed by the polysaccharide was studied. The results showed that the polysaccharide could suppress cytokine levels, NO expression and phagocytic activity.
Plantago asiatica L.; polysacchar ide; RAW264.7 cells; inf ammation; anti-inf ammation
TS201.2
A
1002-6630(2014)23-0249-04
10.7506/spkx1002-6630-201423048
2014-06-26
国家自然科学基金重点项目(31130041);南昌大学食品科学与技术国家重点实验室青年骨干研究基金项目(SKLF-QN-201107);国家自然科学基金地区科学基金项目(31260364);江西省教育厅青年科学基金项目(GJJ11050)
李芬芬(1989—),女,硕士研究生,研究方向为食品科学。E-mail:ncusklifenfen@163.com
*通信作者:谢明勇(1957—),男,教授,博士,研究方向为食品化学、食品营养与安全。E-mail:myxie@ncu.edu.cn



