田玉娟,周 康*,韩新锋,刘书亮
(四川农业大学食品学院,四川 雅安 625014)
乳制品中高产双乙酰乳酸菌的筛选及鉴定
田玉娟,周 康*,韩新锋,刘书亮
(四川农业大学食品学院,四川 雅安 625014)
以四川省生鲜乳和发酵乳为原料,利用MRS培养基进行分离筛选,共分离出39 株乳酸菌,对其中37 株进行产双乙酰的初筛,分离出7 株产量较高的菌株,最后从这7 株中确定出1 株产双乙酰量最高的乳酸菌YJ-110,通过分光光度计法测得该菌株双乙酰的产量为23.826 mg/L。经形态学、生理生化特性和16S rDNA分子鉴定,确定该菌为嗜柠檬酸明串珠菌(Leuconostoc citreum)。
双乙酰;分离鉴定;明串珠菌
近几年,随着酸奶产量的逐年递增,影响人们选择酸奶的因素不仅仅是其功能性,另一个重要因素就是它的风味。酸奶的风味来源于乳酸和羰基化合物,其中双乙酰是构成酸奶风味的主要成分,因此酸奶中双乙酰的含量检测对酸奶风味评价尤为重要[1-2]。双乙酰,又名丁二酮、二乙酰,经稀释后呈强烈的奶油香气,是乳制品中一种重要的风味物质,主要用于配制奶制品香精(黄油、乳酪、牛奶、酸乳酪)和香草、巧克力、糖果、坚果、咖啡以及水果等香精[3-5]。目前乳品中双乙酰含量的测定方法主要有紫外分光光度计比色法、气相色谱法等[6-8]。邻苯二胺比色法由于其方法简单容易操作,仪器设备简易,适宜在实验室推广等特点而得到普遍应用。但目前国内双乙酰的生产工艺主要是采用亚硝化法,但该工艺在制备过程产生大量硫酸氢钠,难以回收,且亚硝酸类物质毒性大、沸点低,对环境危害严重[9-10]。随着人们生活水平的提高,以及对食品安全的关注度不断提升,其使用效果和安全性已经不能满足消费者和食品香精香料行业的发展需求。因而,国内外的研究重点转向了采用崇尚自然、回归自然的微生物发酵法来制备双乙酰[11-12]。
本实验从四川省本地生鲜乳和发酵乳中分离筛选高产双乙酰的乳酸菌菌株,通过生理生化特性和16S rDNA鉴定其属种,并用紫外分光光度计比色法测得其含量。以期为解决以化学合成生产双乙酰带来的环境污染等一系列的问题奠定理论基础,为满足食品行业对天然双乙酰等风味物质的需求提出发展方向。
1 材料与方法
1.1菌种与试剂
菌种分离自四川本地的生鲜乳和发酵乳制品。选用乳酸菌培养基(MRS)作为微生物生长培养基(质量分数,下同):葡萄糖2%、蛋白胨1%、牛肉膏1%、酵母膏0.5%、磷酸氢二钾0.2%、乙酸钠0.5%、柠檬酸氢二铵0.2%、硫酸镁0.058%、硫酸锰0.025%、吐温-80 0.1%,pH 6.5。含有12%脱脂乳粉的脱脂乳培养基。
聚合酶链式反应(polymerase chain reaction,PCR)反应用Taq酶、Marker DL2000、Golden View、Loading Buffer和TIANGEN细菌基因组DNA提取试剂盒-离心柱型宝生物工程(大连)有限公司;双乙酰溶液标准品、4 mol/L盐酸、1%邻苯二胺、16%三氯乙酸均为分析纯。
PCR通用引物27F,由生工生物工程(上海)股份有限公司合成:上游引物:5’-AGAGTTTGATCCTGGCTCAG-3’;下游引物:5’-TACGGCTACCTTGTTACGACTT-3’。
1.2方法
1.2.1乳酸菌的初筛
取生鲜乳和发酵乳样品各25 mL,分别加入装有225 mL无菌生理盐水的无菌三角瓶中,充分振摇,进行10 倍梯度稀释。分别取稀释度为10-1、10-3、10-5、10-7的稀释液1 mL倾注于添加了1.5% CaCO3的MRS固体培养基上,在37 ℃条件下培养48~72 h后,选取优势菌落划线分离。将分离纯化后的乳酸菌菌株进行接触酶实验和革兰氏染色。
1.2.2产双乙酰菌株的复筛
标准曲线的制备:将12%的脱脂乳培养基121 ℃灭菌7 min后迅速冷却,配制质量浓度为0、2.0、5.0、10.0、15.0、20.0、25.0、30.0、35.0 mg/L的双乙酰溶液[13]。取各质量浓度的标准液10 mL,加入同等体积16%三氯乙酸溶液,振荡摇匀,静置,取10 mL上清液均分入2 支试管中。1号管中加入0.5 mL 1%邻苯二胺溶液,2号管作为对照,振摇后黑暗静置30 min,分别加入4.0 mol/L HCl 溶液,1号管2.0 mL,2号管2.5 mL,终止反应。在335 nm波长处测定各质量浓度对应的OD335nm值。以双乙酰质量浓度为横坐标,OD335nm值为纵坐标绘制双乙酰标准曲线[14]。
乳酸菌产双乙酰含量的测定:将12%的脱脂乳培养基121 ℃灭菌7 min后迅速冷却,接种2%乳酸菌菌悬液,37 ℃摇床培养24 h,取10 mL上清液,分两支试管,每支5 mL,按上述方法测定各OD335nm值,根据标准曲线回归方程计算出双乙酰的含量。每次实验做3 个平行取平均值,筛选出产双乙酰较多的菌株。
1.2.3PCR扩增与16S rDNA的鉴定
用细菌基因组提取试剂盒提取乳酸菌的总DNA,并以此为模板,扩增其16S rDNA序列。25 μL扩增体系和扩增程序分别为:12.5 ☒L 2×PCR Master Mix,1 ☒L F-Nuc(10 μmol/L),1 ☒L R-bla(10 μmol/L),1 ☒L模板DNA,9.5 ☒L ddH2O;94 ℃预变性5 min,94 ℃变性45 s、56 ℃退火45 s、72 ℃延伸1.5 min以上循环30 次,最后延伸72 ℃ 10 min。取PCR扩增产物及DL2000 Marker各5 μL,采用1%琼脂糖凝胶(含Golden View)电泳方法检测,电压85 V,水平电泳50 min,用凝胶成像仪观察、拍照。PCR产物经电泳检测后,应在预计的分子质量,约1 500 bp 处出现单一DNA条带,然后将图像拍照保存。将PCR扩增产物寄至生工生物工程(上海)股份有限公司使用通用引物27F双向测通。将取得的16S rDNA基因测序结果进行BLAST在线分析,进行同源性序列相似度比较,根据其同源性鉴定菌种。
1.2.4生理生化实验鉴定
采用糖(醇)发酵实验、H2O2酶实验、产硫化氢实验、精氨酸水解实验对菌株进行鉴定。
2 结果与分析
2.1乳酸菌的筛选结果
2.1.1乳酸菌的初筛结果
挑取优势菌落,分别划线于添加1.5% CaCO3MRS培养基上进行分离纯化,初步分离纯化出菌株39 株,经过革兰氏染色镜检,接触酶反应,保存革兰氏阳性,接触酶阴性菌株37 株。如图1所示,菌株YJ-110在MRS固体平板上直径为1~2 mm,白色,不透明,菌落凸起有溶钙圈,光滑圆整,边缘整齐。革兰氏染色为G+菌,椭球状,少数成对或成链状,无芽孢。
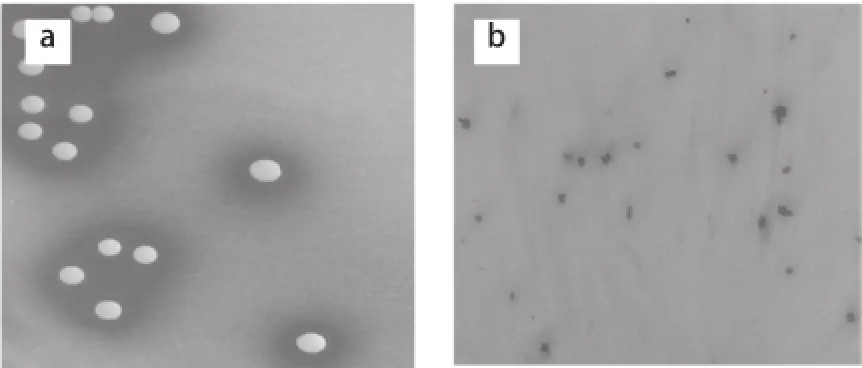
图1 菌株YJ-110的菌落特征(a)及个体形态(b)图(10×10000)Fig.1 Colony characteristics (a) and morphological features (b) of strain YJ-110 (10×100)
2.1.2产双乙酰菌株的初筛结果
采用邻苯二胺显色法测定双乙酰的含量,其标准曲线的回归方程为y=0.040 3x-0.033 2(R2=0.998 6),表明总误差中只有0.14%属于随机因素的影响,故该回归直线可用于确定待测样的双乙酰含量。
以初筛37 株菌株活化后,菌龄为18 h的培养菌液,按2%接种于12%的脱脂乳培养基中,37 ℃条件下培养24 h后,用紫外分光光度计测得OD335nm值,根据双乙酰标准曲线回归方程可计算出37 株菌株产双乙酰的含量,结果见表1。YJ-103、YJ-105、YJ-110、YJ-202、YJ-203、YJ-322、YJ-324这7 株菌产双乙酰的能力较强,因此将产量较高的这7 株菌进行下一步复筛实验。

表1 产双乙酰菌株初筛结果Table1 Results of preliminary screening for diacetyl production
2.1.3产双乙酰菌株的复筛结果
将初筛所得的7 株菌株活化,取菌龄为18 h的菌悬液,以2%量接种于12%的脱脂乳培养基中,在37 ℃条件下摇床培养24 h后,测得OD335nm值,根据所得双乙酰标准曲线回归方程可计算出7 株菌株产双乙酰的含量,结果见表2。YJ-110菌株是产双乙酰含量最高的菌株,产双乙酰的平均量为23.826 mg/L。对比表1中的数据,发现同样在37 ℃、24 h培养条件下,通过摇床培养菌株较静置培养产双乙酰的含量有所增加。这主要可能是由于溶氧量改变导致的。
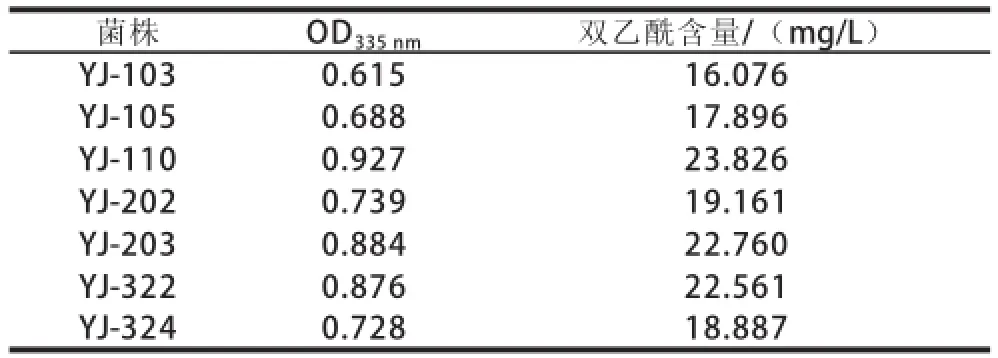
表2 产双乙酰菌株复筛结果(n=3)Table2 Results of secondary screening for diacetyl production (n=3)
2.2菌种的鉴定
2.2.1生理生化鉴定结果
对菌株YJ-110进行生理生化实验,测定结果查阅《细菌鉴定手册》和《伯杰氏手册》,鉴定菌株YJ-110为嗜柠檬酸明串珠菌(Leuconostoc citreum),结果见表3。
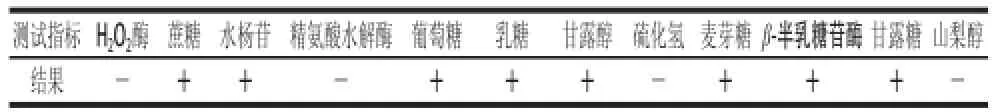
表3 菌株YJ-110的生理生化反应鉴定Table3 Identification of strain YJ-110 by physiological characteristics and biochemical reactions
2.2.2分子生物学鉴定
对PCR产物进行测序,并将结果在NCBI上进行BLAST在线分析,其同源性序列相似度比较发现,与Leuconostoc citreum KM20最接近,相似度为99%。图2为所筛37 株菌中部分菌株的16S rDNA的电泳图,可以发现所有的菌株序列长度均在1 500 bp左右,在1 000~2 000 bp之间,符合目的基因的分子质量。
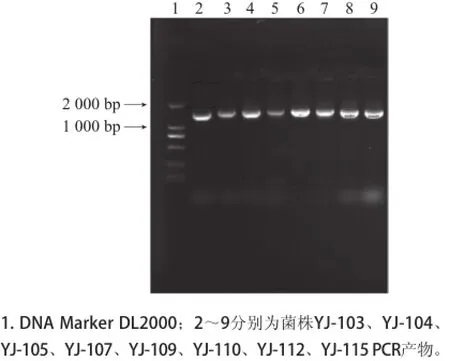
图2 菌株的16S rDNA琼脂糖凝胶电泳图Fig.2 Agarose gel electrophoresis patterns of 16S rDNA
综合细菌形态学、生理生化特征和16S rDNA比对,该菌株鉴定为嗜柠檬酸明串珠菌(Leuconostoc citreum)。
3 结 论
双乙酰测定过程中,样品的处理是必要的过程。刘鹏等[15]在测定样品双乙酰时,先将样品用蒸馏水稀释后,采用蒸馏的方法,利用乙醚等有机溶剂冰浴回收,然后萃取得到双乙酰待测样品。但发现这种方法耗时长,样品中的双乙酰在萃取回收时有一定的损失。所以本实验用16%的三氯乙酸将样品中的蛋白沉淀,然后用离心机离心过滤得到透明溶液再进行测定。这种方法需要时间少,也减少了样品中双乙酰的损失,保证了测定的准确性[16-17]。
在进行产双乙酰菌株筛选的过程中,分别对培养菌株进行了初筛和复筛。将初筛和复筛的方案和数据进行对比后,发现同样在37 ℃、24 h培养条件下,通过摇床培养菌株较静置培养产双乙酰的含量有所增加,这与Vedamuthu[18]报道的在生产中振荡培养可以促进双乙酰生成的结果相符,也与邵亚东[19]的结论有相似之处。对于双乙酰含量测定,邵亚东[19]筛选的最高产双乙酰菌株QH5-6产量达34.34 mg/L,彭涛等[20]筛选的最高产双乙酰菌株S1产量为16.287 mg/L,与本实验研究所得的数据有一定的差别,究其原因可能是由于实验材料的不同或者紫外分光光度计的光源强弱等因素造成的差异。
本实验从采集的郫县生鲜乳和伊利畅轻原味风味发酵乳中分离得到的39 株乳酸菌,经两次筛选出一株产双乙酰能力最强的菌株YJ-110,通过细菌形态学、生理生化特征和16S rDNA比对,鉴定YJ-110菌株为嗜柠檬酸明串珠菌。该菌株的获得不仅可为解决因化学合成生产双乙酰带来的环境污染等一系列问题提供理论基础,也可为满足食品行业对天然双乙酰等风味物质的需求提供实用价值。
[1] 金鹏. 益生菌研究进展[J]. 农产品加工: 创新版, 2009(11): 70-72.
[2] PASSERINI D, LAROUTE V, CODDEVILLE M, et al. New insights into Lactococcus lactis diacetyl- and acetoin- producing strains isolated from diverse origins[J]. International Journal of Food Microbiology, 2013, 160(3): 329-336.
[3] 孙宝国, 何坚. 香料化学与工艺学[M]. 北京: 化学工业出版社, 2004: 172-174.
[4] DAY G, LEBOUF R, GROTE A, et al. Identification and measurement of diacetyl substitutes in dry bakery mix production[J]. Jounral of Occupational and Environmental Hygiene, 2011, 8(2): 93-103.
[5] MORE S S, RAZA A, VINCE R. The butter flavorant, diacetyl,forms a covalent adduct with 2-deoxyguanosine, uncoils DNA,and leads to cell death[J]. Journal of Agricultural and Food Chemistry, 2012, 60(12): 3311-3317.
[6] RAMOS R M, PACHECO J G, GONCALVES L M, et al. Determination of free and total diacetyl in wine by HPLCUV using gas-diffusion microextraction and pre-column derivatization[J]. Food Control, 2011, 24: 220-224.
[7] OJEDA A G, WROBEL K, ESCOBOSA A R C, et al. Highperformance liquid chromatography determination of glyoxal, methylglyoxal, and diacetyl in urine using 4-methoxy-ophenylenediamine as derivatizing reagent[J]. Analytical Biochemistry, 2014, 449: 52-58.
[8] 吕嘉枥, 李成涛. 酸奶中中丁二酮含量的测定方法初探[J]. 中国乳品工业, 2006, 34(1): 21-22.
[9] 欧阳天惠, 田玉红, 张浩, 等. 丁二酮的合成研究[J]. 北京工业大学学报: 自然科学版, 2008, 26(5): 1-4.
[10] TEUSINK B, SMID E J. Modelling strategies for the industrial exploitation of lactic acid bacteria[J]. Nature Reviews Microbiology, 2006, 4(1): 45-56.
[11] 汪薇, 肖燕清, 白卫东. 符合乳酸菌发夹产双乙酰的研究[J]. 食品工业科技, 2011, 32(7): 214-216.
[12] SILVA G P, MACK M, CONTIERO J. Glycerol: a promising and abundant carbon source for industrial microbiology[J]. Biotechnology Advances, 2009, 27(1): 30-39.
[13] 吕嘉枥, 韩迪, 李成涛. 乳品中双乙酰检测方法研究[J]. 食品科学,2007, 28(1): 276-277.
[14] IMHOF R, GLATTLI H, BOSSET J. Volatile organic compounds produced by thermophilic and mesophilic mixed strain dairy starter cultures[J]. Federal Dairy Research, 1994, 27(5): 442-449.
[15] 刘鹏, 王丹. 酸奶中联乙酰含量测定方法的初步探讨[J]. 中国乳品工业, 1992, 20(4): 60-62.
[16] BORTNOWSKA G. Effects of pH and ionic strength of NaCl on the stability of diacetyl and (-)-α-pinene in oil-inwater emulsions formed with food-grade emulsifiers[J]. Food Chemistry, 2012, 135: 2021-2028.
[17] de LEONARDIS A, LOPEZ F, NAG A, et al. Occurrence and persistence of diacetyl in unfermented and fermented milk[J]. European Food Research and Technology, 2013, 236(4): 691-697.
[18] VEDAMUTHU E R. The Dairy Leuconostoc use in dairy products[J]. Journal of Dairy Science, 1994, 77(9): 2725-2737.
[19] 邵亚东. 传统发酵乳制品中乳酸菌产双乙酰特性的研究[D]. 呼和浩特: 内蒙古农业大学, 2007.
[20] 彭涛, 潘道东, 曾小群, 等. 产丁二酮乳酸菌发酵的筛选及其发酵条件的优化[J]. 中国食品学报, 2011, 11(8): 34-41.
Isolation and Identification of High-Level Diacetyl-Producing Lactic Acid Bacteria from Milk Products
TIAN Yujuan, ZHOU Kang*, HAN Xinfeng, LIU Shuliang
(College of Food Science, Sichuan Agricultural University, Ya’an 625014, China)
In this study, using MRS medium, we isolated 39 strains from raw milk and fermented milk from Sichuan province, of which 37 were found to be capable of diacetyl. Seven strains with increased diacetyl-producing ability were selected from the 37 strains and YJ-110, a Lactobacillus strain, produced the highest yield (23.826 mg/L as measured by spectrophotometer) of diacetyl among the seven strains. Based on morphological, physiological and biochemical characteristics and 16S rDNA sequences, this strain was identified as Leuconostoc citreum.
diacetyl; isolation and identification; Leuconostoc citreum
TS254
A
1002-6630(2015)03-0162-04
10.7506/spkx1002-6630-201503031
2014-02-21
田玉娟(1990—),女,本科,研究方向为食品生物技术。E-mail:690813931@qq.com
周康(1983—),男,副教授,博士,研究方向为食品生物技术。E-mail:kang_zhou@163.com



