尹 创 左登平(宿州市食品药品检验所 宿州234000)
宿州市2014年药品不良反应监测情况分析
尹创左登平(宿州市食品药品检验所宿州234000)
摘要:目的:分析药品不良反应(ADR)数据,为临床合理用药提供参考。方法:收集宿州市2014年全年ADR报告数据,并进行分析统计。结果:ADR病例报告中涉及的药品品种各季度有所变化,报告主要来自医疗机构和药品经营企业,来自药品生产企业的相对较少。结论:合理使用药物并加强用药检测,减少不良反应。
关键词:药品不良反应监测情况
国家制定《药品不良反应报告和监测管理办法》的目的是保障人民群众的身体健康和用药安全[1]。宿州市药品不良反应监测中心,始终坚持以科学发展观为指导,树立和实践科学监测理念,大力推动药品不良反应监测工作。在有关部门、单位的大力支持下,2014年宿州市监测工作发展迅速,成效显著。
1 2014 年宿州市ADR工作开展情况分析
2014年宿州市药械监测工作成绩喜人。市ADR中心评价的病例报告荣获2014年全省药械安全性监测病例报告质量评选活动三等奖;宿州市10家单位13份药械不良反应病例报告质量位居全省前三十名,并获得通报表彰。2014年全年共收集上报药品不良反应病例报告8101份,其中新的严重的病例报告1460份,占报表总数的18%;医疗机构病例报告数占报告总数的83.0%;每百万人口报告数1243份。
1.1各个季度报告情况分析:报告主要来自医疗机构和药品经营企业,来自药品生产企业的仅3份,所占比例相对较小。百万人口的报告数量在前三季度相比去年同期有所下降,第四季度提升显著。新的严重的病例除第一季度略有下降外,其他各季度都比去年同期有所增长。各季度的报告情况见表1,报告来源情况见表2。
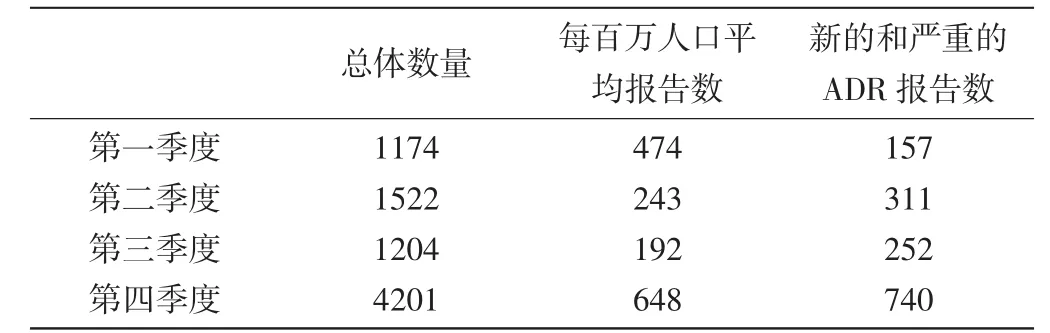
表1
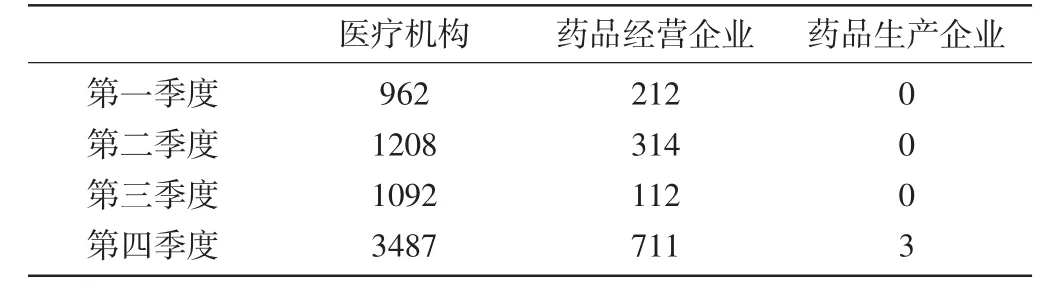
表2
1.2涉及药品总体情况:ADR病例报告中涉及的药品品种各季度有所变化,第一季度ADR病例报告涉及的药品前三位分别是左氧氟沙星、阿奇霉素、阿莫西林克拉维酸钾;第二季度前三位分别是左氧氟沙星、川芎嗪、参麦;第三季度前三位分别是左氧氟沙星、环丙沙星、头孢曲松;第四季度前三位分别是左氧氟沙星、头孢曲松、阿奇霉素。全年ADR病例报告累及系统伤害前三位的是胃肠系统损害、皮肤及其附件损害、中枢及外周神经系统损害。ADR病例报告中涉及的药品以化学药品为主,其次是中药制剂和生物制剂。各季度ADR病例报告中药品分类情况见表3。
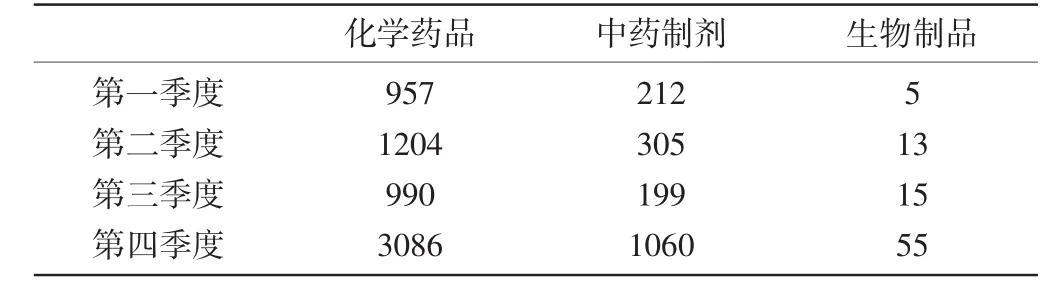
表3
1.3涉及基本药物情况:全年ADR病例报告中涉及的国家基本药物中,左氧氟沙星排名第一位,其中第一季度排名前三位的是左氧氟沙星、阿莫西林克拉维酸钾、环丙沙星;第二季度排名前三位的是左氧氟沙星、环丙沙星、头孢曲松钠;第三季度排名前三位的是左氧氟沙星、环丙沙星、头孢曲松钠;第四季度排名前三位的是左氧氟沙星、头孢曲松、头孢他啶。全年报表涉及基本药物累及系统及主要不良反应表现以胃肠系统损害最高,其次为皮肤及其附件损害。第一季度、第二季度、第三季度和第四季度提交的报告中涉及国家基本药物分别是105个、136个、126个和241个。各季度报告中排名前列的药品类别也有不同,但排名前两位的都是抗感染药、中药制剂。各季度ADR病例报告中涉及国家基本药物的具体品种见表4。
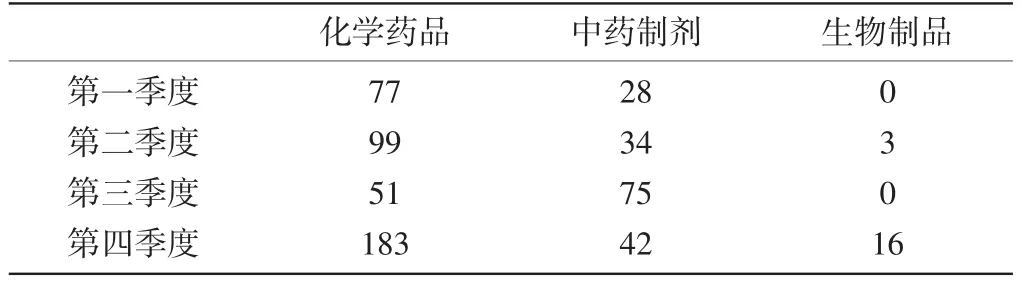
表4
1.4重点监测品种情况:全年报表涉及《国家药品不良反应信息通报》的品种共162个2134份,其中严重报告6份。涉及国家重点监测品种共64个1302份,其中严重报告3份,主要表现为过敏性休克和面部水肿、嗜睡。
1.5疑似预防接种异常反应监测信息情况:全年通过疑似预防接种异常反应监测信息管理系统监测到本市疑似预防接种异常反应监测信息共436例,基本都是一般反应,9例为异常反应,1例偶合反应,3例待定,报告中以百白破(无细胞)发生率最高,共250例。AEFI<1的报告所占比例较大,为209例,其次为AEFI 1岁,为148例。
2 讨论
2.1药品生产企业的ADR报告数量有待提高:全年药品生产企业报告数量仅为3例,这可能与药品生产企业对ADR的认识和重视程度有关。药品生产企业往往认为一旦报告ADR就是药品质量的问题,是假药劣药。同时,药品生产企业把ADR监测认为是药品使用和管理部门的事,药品一经卖出,就与企业没什么关系了。ADR报告有无与企业的效益无关这一原因也是药品生产企业不报或漏报的一个重要因素。药品生产企业有的比较注重从经济效益角度考虑问题,他们认为报告ADR是一件额外的事情,报与不报不能给企业或医疗机构增加效益。还有的药品生产企业缺乏ARR监测必要的激励和约束机制,使监测制度流于形式[2]。建议药品生产企业加强与医疗机构的合作,建立与完善药品上市后安全性、有效性等再评价工作,在主动收集本企业产品的药品不良反应/事件的同时,开展药品安全性、有效性研究,及时修订、完善药品说明书。
2.2部分报表质量有待提高:2014年,ADR的报表质量较以往有了很大的提高,但在对报表的审核中仍然发现存在一些问题:一是部分报告存在信息缺失,如患者性别、民族、体重、既往与家族不良反应史;二是不良反应过程描述中不良反应症状的描述过于简单,部分报表仍存在缺少不良反应发生时间及采取治疗措施的时间的描述;三是关联性评价存在评价不准确。今后需进一步加强宣传培训教育,提高全社会对ADR监测工作重要性的认识,分期分批对辖区内药品生产、经营企业、医疗机构相关人员进行培训,扩大基层ADR监测工作骨干队伍,提升ADR报告人员的业务水平,规范病例报表的质量,稳步提高不良反应报告的数量。
参考文献
[1]陈志勇,项琪琪,尤昱洲.2012年度某市不良反应及医疗器械不良事件监测情况分析[J].中国医药指南,2013,11(24):780-781.
[2]程民.我市药品不良反应监测工作开展情况现状与建议[J].安徽医药,2007,11(4):374-375.
中图分类号:R969.3
文献标识码:B
文章编号:1672-8351(2016)04-0168-02



