张媛媛,聂少平,万 成,谢明勇*
响应面法优化离子交换法固定化β-D-呋喃果糖苷酶
张媛媛,聂少平,万 成,谢明勇*
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
以大孔阴离子树脂D311为载体,对日本曲霉来源的β-D-呋喃果糖苷酶进行离子交换法固定化。研究温度、pH值、时间、游离酶液酶活力对固定化效果的影响,并在此基础上运用响应面法对固定化条件进行优化。结果表明,最佳固定化条件为:室温、pH6.6、固定化时间4h、游离酶液酶活力为900U/mL,在此条件下,固定化β-D-呋喃果糖苷酶生产的低聚果糖产量可达58.16%。
β-D-呋喃果糖苷酶;离子交换法;固定化;响应面法
低聚果糖(fructooligosacchrides,FOS)又名蔗果低聚糖具有良好的生理功能[1-2],特别对改善人体内微生物环境有很大帮助,使人体内有益菌群——双歧杆菌数量增多,同时抑制有害菌的生长、改善肠道环境、防止便秘[3-5];除此之外还具有降低血脂和胆固醇、预防龋齿、提高机体免疫力等重要功能。
工业上,主要以蔗糖作底物用微生物酶法生产低聚果糖。一般认为生产低聚果糖是通过β-D-呋喃果糖苷酶催化蔗糖水解并将果糖基转移到蔗糖分子的果糖残基位置上而合成的。由于游离酶在工业生产中反应条件较难控制,容易流失,而固定化酶与其相比具有贮存稳定性高、分离回收容易、可多次重复使用、操作连续可控、工艺简便等一系列优点[6-7]。树脂价格低廉,物化性能稳定,易再生,作为固定化载体有着广阔的应用前景,并有较为成功的范例[8-9]。离子交换树脂是一类不溶且具有三维空间网状骨架结构的亲水性功能高分子。连接在树脂骨架上的功能基,可通过吸附、共价键、离子键、配位键、微胶囊等形式及其他手段将酶固定在树脂上,构成固定化酶[10]。离子交换法生产的固定化酶具有机械强度高,性质稳定,可以反复再生使用,工作寿命长等优点。
本研究以大孔阴离子树脂D311为载体,对日本曲霉(Aspergillus japonicus)来源的β-D-呋喃果糖苷酶进行固定化,并采用响应面法对固定化条件进行优化,以期为低聚果糖的工业化生产提供参考。
1 材料与方法
1.1 材料与试剂
琼脂、酵母膏 市售。
蔗糖(Suc,分析纯)、NaNO3、K2HPO4、(NH4)SO4、MgSO4·7H2O、乙腈(色谱纯) 上海国药集团化学试剂有限公司;树脂D311 苏青水处理工程集团有限公司;低聚果糖标品:蔗果三糖(GF2,纯度99.8%)、蔗果四糖(GF3,纯度99.8%)、蔗果五糖(GF4,纯度86.7%)日本和光纯药工业株式会社。
1.2 仪器与设备
ELSD-UM 3000高效液相色谱仪-蒸发光散射检测器上海通微科技有限公司;XWK-3A空气泵 天津市华生分析仪器厂;KQ2200E超声波清洗器 昆山市超声仪器有限公司;ZHWY-2102恒温培养振荡器 上海智诚分析仪器制造有限公司;SB-2000水浴锅 上海爱郎仪器有限公司;LDZX-50KB立式压力蒸汽灭菌锅 上海申安医疗器械厂;FA1104电子天平 上海精天电子仪器厂。
1.3 菌种与培养基
日本曲霉,实验室筛选保藏。
查氏培养基:蔗糖30g、琼脂15g、NaNO33g、K2HPO41g、MgSO4·7H2O 0.5g、FeSO40.01g,水1000mL,pH6.0;发酵培养基:蔗糖50g、酵母膏35g、K2HPO41g、MgSO4·7H2O 1g、(NH4)2SO43g,水1000mL,pH6.0。
1.4 方法
1.4.1 β-D-呋喃果糖苷酶游离酶液的制备
取适量日本曲霉菌体,用无菌水配成菌悬液,精确量取3mL菌悬液加入到液体培养基中,30℃振荡培养48h,摇床转速120r/min。培养结束后,将发酵液进行细胞破碎,4℃、8000r/min离心10min,取上清液,4℃备用。
1.4.2 离子交换树脂的预处理
离子交换树脂先用蒸馏水浸泡胀润,去杂,然后用4g/100mL NaOH和1.3mol/L HCl溶液交替在磁力搅拌器下搅拌浸泡10h,并分别用蒸馏水冲洗至中性,最后用两倍体积以上蒸馏水浸泡于4℃冰箱中保存备用[11]。
1.4.3 固定化β-D-呋喃果糖苷酶
以大孔阴离子树脂D311为固定化载体,取5g处理好的树脂,放入250mL锥形瓶中,加入25mL游离酶液,放入摇床中,在室温下,以120r/min的转速振荡5h,取出后静置1h,抽干,用蒸馏水洗涤,直至洗出液中无酶活,即可得到固定化β-D-呋喃果糖苷酶,备用。
1.4.4 响应面试验设计[12-15]
根据单因素试验结果,选取对固定化结果影响较大的3个因素,以低聚果糖产量为响应值进行响应面试验,因素及水平设计见表1。根据Box-Benhnken的中心组合试验设计原理,进行三因素三水平的响应面分析试验,15个试验点可以分为两类,其一是析因点,自变量取值在X1、X2、X3所构成的三维顶点,共有12个析因点;其二是零点,为区域的中心点,零点试验重复3次,用以估计试验误差。
1.4.5 低聚果糖的生产及其测定方法
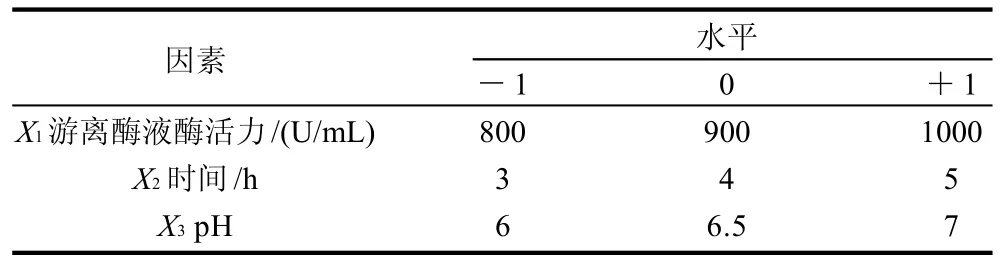
表1 β-D-呋喃果糖苷酶的固定化条件优化设计表Table 1 Factors and levels in the response surface design
将适量制备的固定化酶加入到用柠檬酸缓冲液(0.1mol/L,pH5.4)配制的50g/100mL蔗糖溶液中,50℃反应1h。反应结束后,煮沸5min,8000r/min离心10min,将上清液过0.45μm滤膜,采用高效液相色谱-蒸发光检测法对低聚果糖进行检测,检测条件为:色谱柱:Waters NH2分析柱(4.6mm×300mm,5μm),流动相:乙腈(A)、水(B),梯度洗脱[16];流速:1.0mL/min;柱温:室温;进样量:10μL;ELSD的漂移管温度:85℃;载气:空气流速2.0L/min。
1.4.6 固定化酶固定化效果测定
采用低聚果糖产率作为衡量固定化酶固定化的效果。

2 结果与分析
2.1 pH值对固定化效果的影响
在pH5.0~7.0、温度25℃、固定化时间5h、游离酶酶活力800U/mL的条件下,考察pH值对固定化酶固定化效果的影响。结果见图1。
一般来讲,溶液的pH值决定着树脂交换基团及交换离子的解离程度,它不但影响树脂的交换容量,而且对交换的选择性也有很大影响。D311作为弱碱性树脂,溶液pH值越低,其交换能力越高,所以应在pH≤7.0的溶液中使用,但是对于生物活性分子来说,过强的吸附会增加酶蛋白变性失活的机率,因此溶液的pH值不能太低。由图1可知,当游离酶液的pH值小于6时,固定化酶活力较低,所以低聚果糖产率较低;当pH值为6左右时,固定化效果较好;随着pH值增加,树脂的吸附能力有所下降,固定化效果不佳,导致低聚果糖产率有所降低。
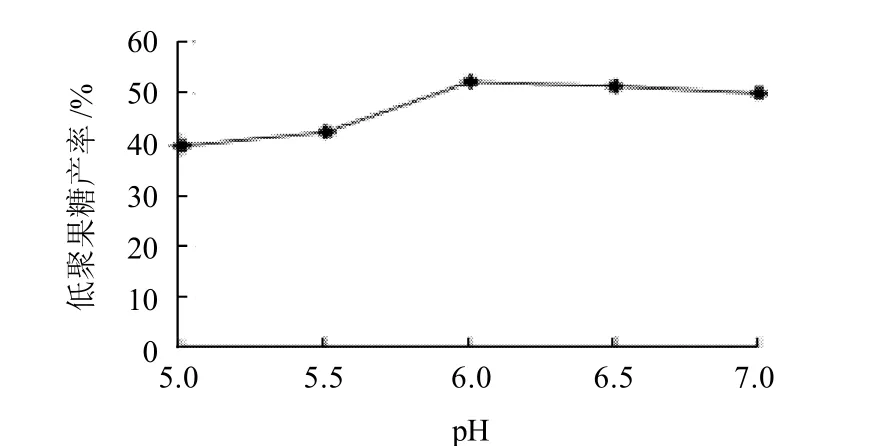
图1 pH值对固定化酶固定化效果的影响Fig.1 Effect of pH on the catalytic ability of immobilized β-fructofuranosidase
2.2 固定化时间对固定化效果的影响
在温度25℃、pH6.5、游离酶酶活力800U/mL的条件下,考察固定化时间分别为2、3、4、5、6h时对固定化酶固定化效果的影响,结果见图2。
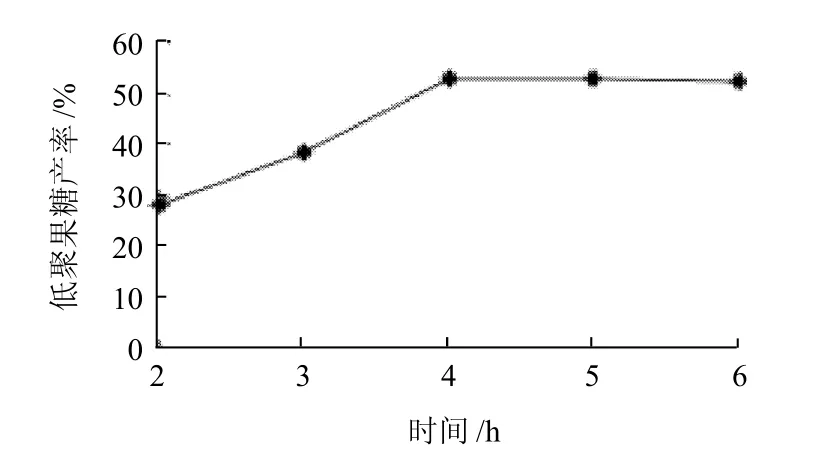
图2 固定化时间对固定化酶固定化效果的影响Fig.2 Effect of immobilization time on the catalytic ability of immobilized β-fructofuranosidase
固定化时间对固定化效果和生产周期长短都有很大影响。由图2可知,固定化时间在2~4h范围内时,低聚果糖产率随着时间延长而增大,当时间达到4h后,低聚果糖产率增幅趋于平缓,基本保持稳定,从生产周期角度考虑,固定化时间不宜过长,选取4h左右。
2.3 游离酶液酶活力对固定化效果的影响
在温度25℃、pH6.5、固定化时间5h的条件下,考察游离酶液酶活力分别为600、700、800、900、1000 U/mL时对固定化酶固定化效果的影响,结果见图3。
固定化过程中由于受树脂交换容量的影响,所使用的游离酶液酶活力对固定化结果有很大的影响。若酶液酶活力过低,固定化效果差;若酶活力过高,会造成酶蛋白的浪费,增加成本,故应选择适宜的游离酶液酶活力。由图3可知,当游离酶液酶活力较低时,低聚果糖产率随游离酶液酶活力升高而升高,在900U/mL时达到最大,此后,树脂交换容量可能达到饱和,再提高游离酶液酶活力,对低聚果糖产率没有明显提高。
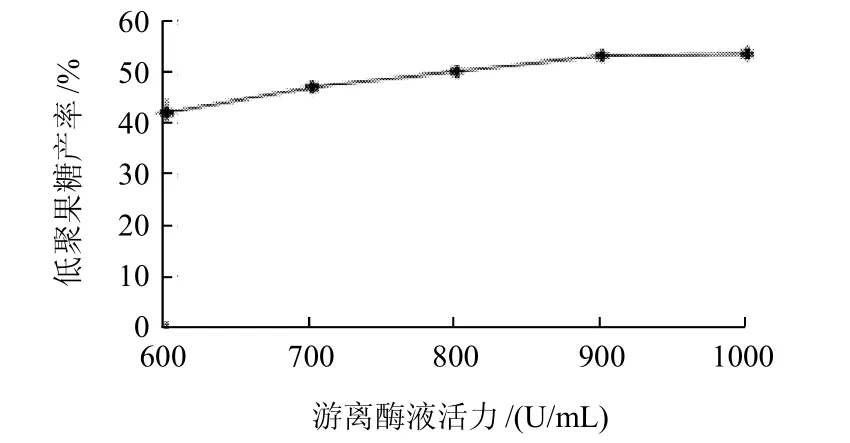
图3 游离酶液酶活力对固定化效果的影响Fig.3 Effect of enzyme activity of free β-fructofuranosidase solution on the catalytic ability of immobilized β-fructofuranosidase
2.4 温度对固定化效果的影响
在pH6.5,固定化时间5h,游离酶酶活力800U/mL的条件下,考察固定化温度分别为20、25、30、35℃时对固定化效果的影响,结果见图4。在30℃时固定化效果较好。因此酶的固定化选择在30℃条件下进行。
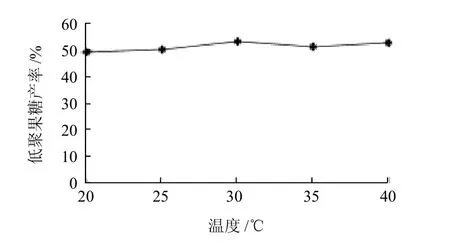
图4 温度对固定化效果的影响Fig.4 Effect of immobilization temperature on the catalytic ability of immobilized β-fructofuranosidase
2.5 响应面试验分析
2.5.1 响应面试验结果
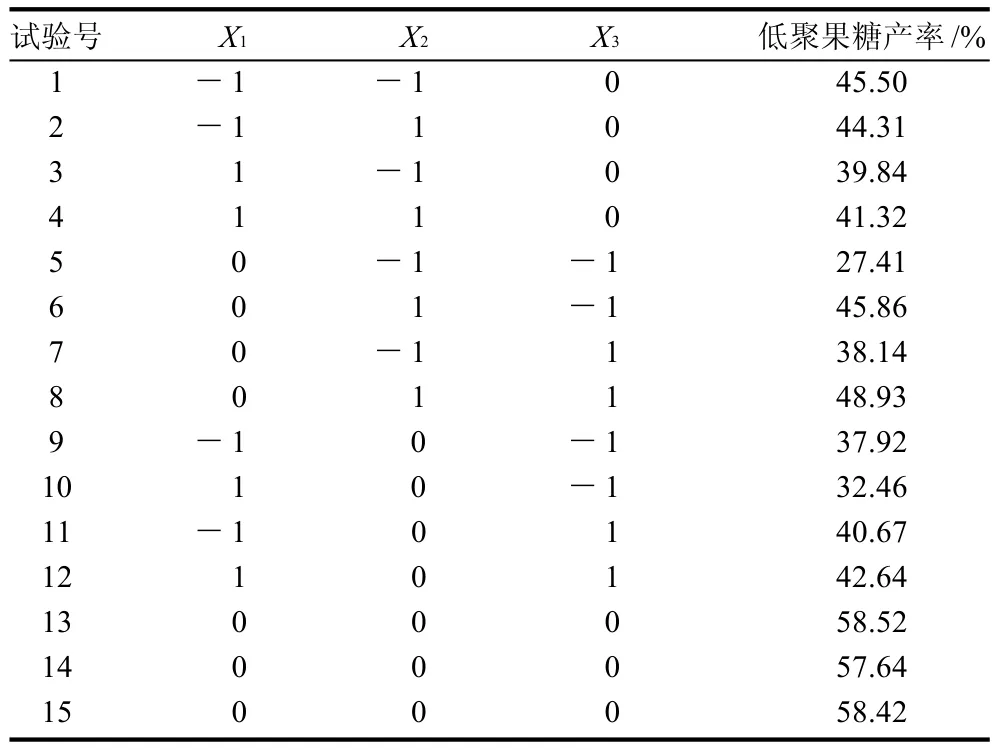
表2 响应面试验设计与分析结果Table 2 Response surface design layout and experimental results
根据表2结果,以低聚果糖产率为响应值(Y),用SAS统计分析软件进行多元回归分析[17-20],经回归拟合后,因素对响应值的影响可用回归方程表示为:
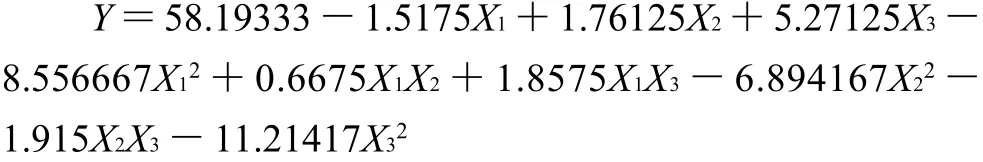
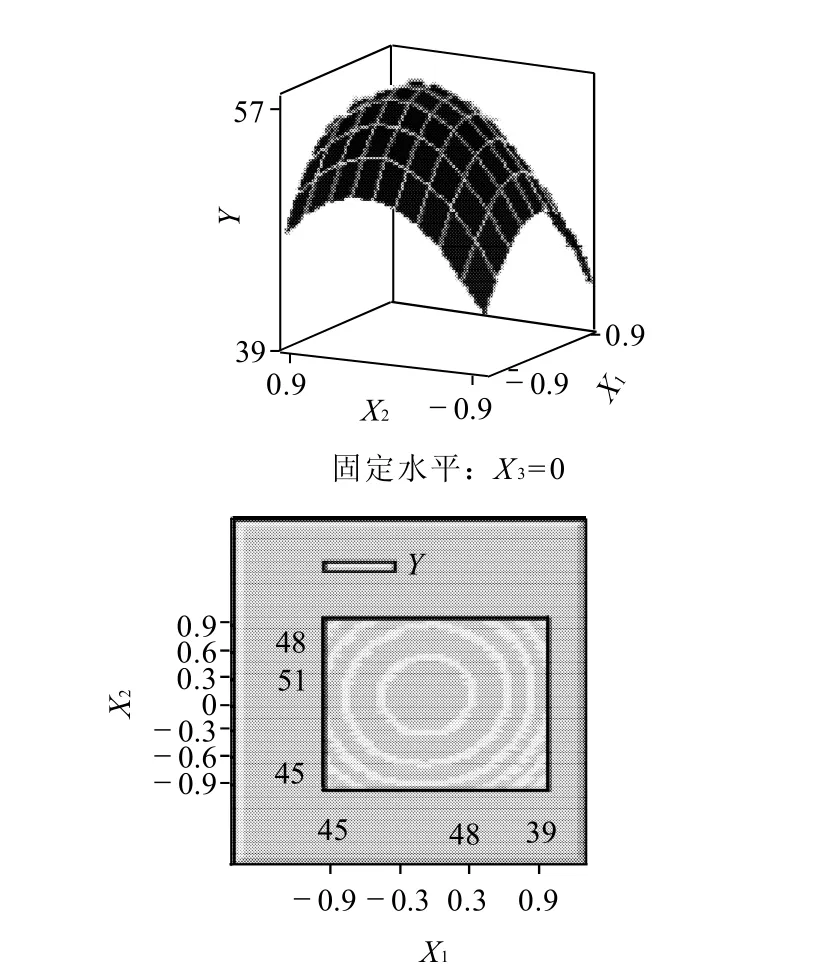
图5 游离酶液酶活力、时间(X1,X2)交互作用的响应面图和等高线图Fig.5 Response surface and contour plots indicating the interactive effects of enzyme activity of freeβ-fructofuranosidase solution and immobilization time
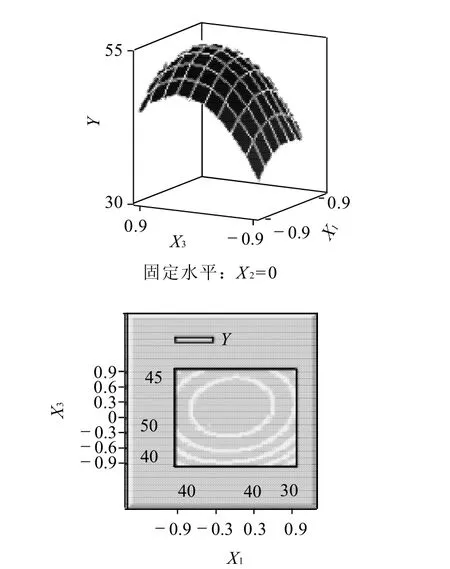
图6 游离酶液酶活力、pH值(X1,X3)交互作用的响应面图和等高线图Fig.6 Response surface and contour plots indicating the interactive effects of enzyme activity of freeβ-fructofuranosidase solution and pH
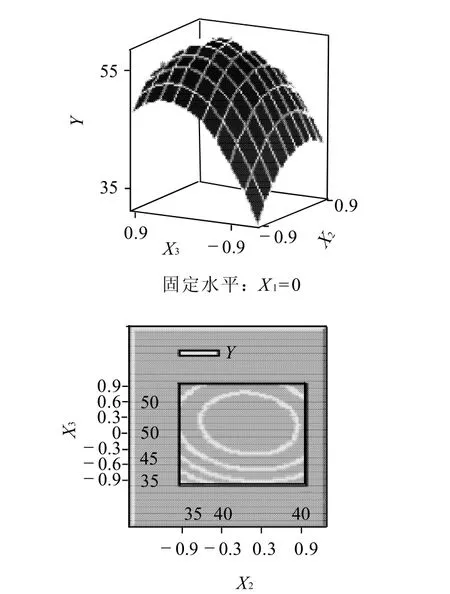
图7 时间、pH值(X2,X3)交互作用的响应面图和等高线图Fig.7 Response surface and contour plots indicating the interactive effects of pH and immobilization time
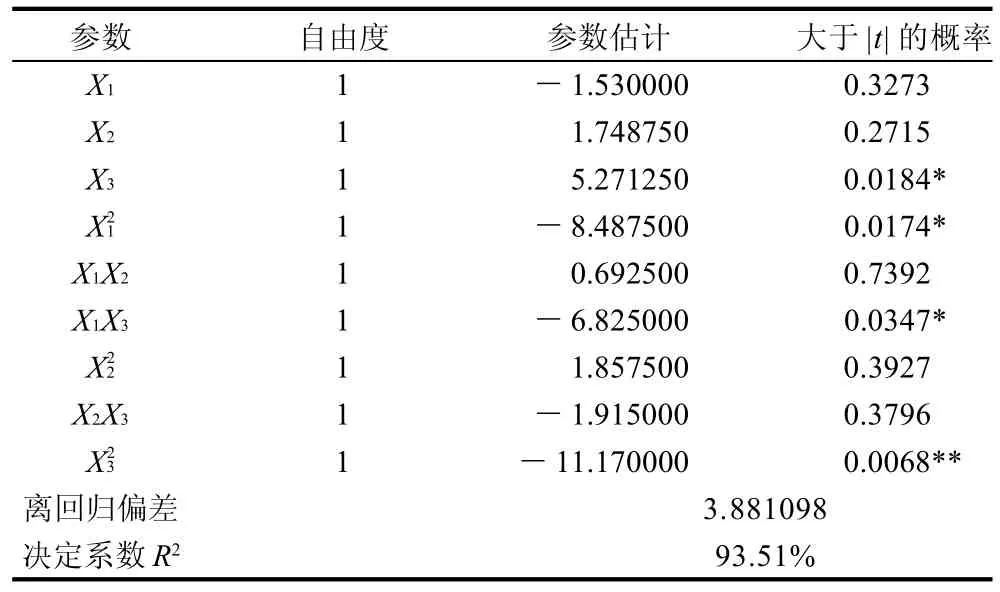
表3 回归方程偏回归系数的估计值Table 3 Estimated values of partial regression coefficients of the developed regression equation with the yield of fructooligosaccharides using immobilizedβ-fructofuranosidase as a function
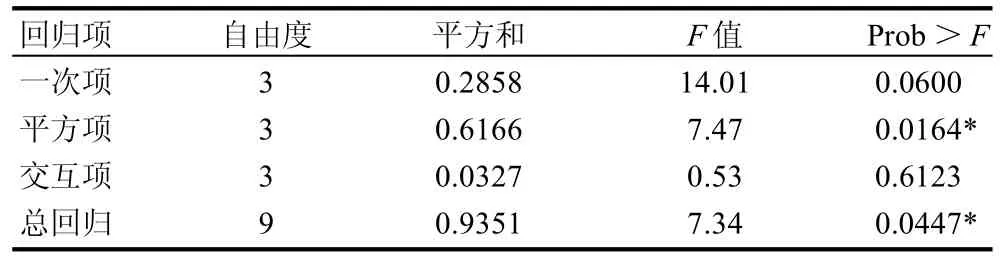
表4 回归方程方差分析表Table 4 Variance analysis for the developed regression equation
根据回归方程作出响应面图及等高线图,由图5~7可直观地看出各因子对响应值的影响变化趋势,而且回归模型存在最大值。再对回归方程进行方差分析及偏回归系数的估计。从表3、4可以看出,用上述回归方程描述各因素与响应值之间的关系,其因变量和自变量之间的线性关系是显着的,决定系数为93.51%,说明回归方程的拟合程度很好,不存在模型拟合不足的现象,因此该响应面能够真实地反映数据结果。
2.5.2 寻求最优值
利用SAS软件进行岭脊分析[21-23]以确定各因素的最佳取值。通过分析可以得到回归模型的最大值点,该点(X1、X2、X3)的代码值为(-0.061932、0.093718、0.222773),与之对应的实际值为X1=893.81U/mL,X2=4.09h,X3=6.61,低聚果糖理论最大产率为58.80%。考虑到实际操作的便利,确定最佳固定化条件:游离酶液酶活力900U/mL、时间4h、pH6.6。
2.5.3 方法重现性实验
在上述优化条件下共进行3次平行验证实验,低聚果糖产率分别为58.69%、57.51%、58.27%,平均产率为58.16%,RSD为1.03%,结果与预测值58.80%是非常接近的。
3 结 论
以大孔径阴离子树脂D311为固定化β-D-呋喃果糖苷酶的载体,对其固定化条件进行研究,在单因素试验基础上,运用响应曲面分析法对其固定化条件进行优化,从而确定最佳固定化条件为:固定化时间4h、游离酶液酶活力900U/mL、pH值为6.6。在此优化条件下,用固定化β-D-呋喃果糖苷酶进行低聚果糖生产,产率可达到58.16%,经验证RSD为1.03%,说明该方法准确、稳定、可行。
[1]LOBO A R, FILHO J M, ALVARES E P, et al. Effects of dietary lipid composition and inulin-type fructans on mineral bioavailability in growing rats[J]. Nutrition, 2009, 25(2): 216-225.
[2]张志兰, 郭杰炎. 蔗果低聚糖合成液的高效液相色谱分析[J]. 分析测试学报, 1997, 16(4): 75-76.
[3]MATUSEK A, MERESZ P, LE T, et al. Effect of temperature and pH on the degradation of fructo-oligosaccharides[J]. Eur Food Res Technol, 2008, 228(3): 355-365.
[4]孔德力, 章学钦. 高纯度低聚果糖生产技术的探讨[J]. 食品科技, 1999 (3): 27-30.
[5]江波, 王璋. 低聚果糖合成酶: 果糖转移酶的部分酶学性质研究[J].无锡轻工业大学报, 1995, 14(4): 290-293.
[6]毛跟年, 李丽维, 齐凤. 固定化酶应用研究进展[J]. 中国酿造, 2009 (8): 17-20.
[7]艾志录, 江正强, 李里特, 等. 大孔树脂D380固定化橄榄绿链霉菌E-86来源木聚糖酶的研究[J]. 食品与发酵工业, 2004, 30(2): 10-14.
[8]郭红彦. DEAE-D/H树脂固定化氨基酰化酶[J]. 化工进展, 2006, 25 (5): 538-541.
[9]张宾. 固定化胰蛋白酶壳聚糖树脂的制备及其对大豆胰蛋白酶抑制剂的吸附性[J]. 食品工业科技, 2007, 28(7): 65-68.
[10]贾红华. 聚苯乙烯树脂固定化D-海因酶的初步研究[J]. 生物加工过程, 2005, 3(2): 41-57.
[11]李再资. 生物化学工程基础[M]. 北京: 化学工业出版社, 2001.
[12]MAJUMDER A, SINGH A, GOYAL A. Application of response surface methodology for glucan production from Leuconostoc dextranicum and its structural characterization[J]. Carbohydrate Polymers, 2009, 75(1): 150-156.
[13]FARSHID G, HABIBOLLAH Y, SEYED M G, et al. Application of response surface methodology for optimization of cadmium biosorption in an aqueous solution by Saccharomyces cerevisiae[J]. Chemical Engineering Journal, 2008, 145(2): 267-275.
[14]GUO Yuxing, PAN Daodong, TANOKURA M. Optimisation of hydrolysis conditions for the production of the angiotensin-Ⅰ converting enzyme (ACE) inhibitory peptides from whey protein using response surface methodology[J]. Food Chemistry, 2009, 114(1): 328-333.
[15]CHEN Xiaochun, BAI Jianxin, CAO Jiaming, et al. Medium optimization for the production of cyclic adenosine 3',5'-monophosphate by Microbacterium sp. no. 205 using response surface methodology[J]. Bioresource Technology, 2009, 100(2): 919-924.
[16]张媛媛, 聂少平, 万成, 等. 高效液相色谱-蒸发光散射检测法同时测定单糖、双糖及低聚果糖[J]. 食品科学, 2009, 30(18): 237-239.
[17]SU Sainan, NIE Huali, ZHU Limin, et al. Optimization of adsorption conditions of papain on dye affinity membrane using response surface methodology[J]. Bioresource Technology, 2009, 100(8): 2336-2340.
[18]WANG Jianlong, WAN Wei. Optimization of fermentative hydrogen production process by response surface methodology[J]. International Journal of Hydrogen Energy, 2008, 33(23): 6976-6984.
[19]TATDAO P, DARRYL S, FRANK S. Process optimisation for fractionating Jerusalem artichoke fructans with ethanol using response surface methodology[J]. Food Chemistry, 2007, 104(1): 73-80.
[20]RAHULAN R, MADHAVAN NAMPOOTHIRI K, SZAKACS G, et al. Statistical optimization of L-leucine amino peptidase production from Streptomyces gedanensis IFO 13427 under submerged fermentation using response surface methodology[J]. Biochemical Engineering Journal, 2009, 43(1): 64-71.
[21]SHIH I L, KUO C Y, HSIEH F C, et al. Use of surface response methodology to optimize culture conditions for iturin a production by Bacillus subtilis in solid-state fermentation[J]. Journal of the Chinese Institute of Chemical Engineers, 2008, 39(6): 635-643.
[22]DEDAVID E SILVA L A, LOPES F C, SILVEIRA S T, et al. Production of cellulolytic enzymes by Aspergillus phoenicis in grape waste using response surface methodology[J]. Appl Biochem Biotechnol, 2009, 152 (2): 295-305.
[23]余晓斌, 郝学财. 纤维素酶液体发酵最佳培养基的确定[J]. 工业微生物, 2005, 35(3): 1-5.
Optimization of Ion Exchange Immobilization of β-Fructofuranosidase Using Response Surface Methodology
ZHANG Yuan-yuan,NIE Shao-ping,WAN Cheng,XIE Ming-yong*
(State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China)
D311 type macroporous anion exchange resin was used as a carrier for the immobilization of β-fructofuranosidase derived from Aspergillus japonicus. The effects of immobilization time and temperature, pH and enzyme activity of free β-fructofuranosidase solution on the catalytic ability of immobilized β-fructofuranosidase were investigated by single factor method and based on this, except immobilization temperature, three other conditions were optimized using response surface methodology. The optimum immobilization conditions were determined as follows: enzyme activity of free β-fructofuranosidase solution 900 U/mL and pH 6.6 for 4 h immobilization at room temperature, and the yield of fructooligosaccharides using immobilized β-fructofuranosidase under these conditions was 58.16%.
β-fructofuranosidase;ion exchange adsorption;immobilization;response surface methodology (RSM)
Q814.2
A
1002-6630(2010)19-0236-05
2010-05-04
教育部“长江学者和创新团队发展计划”项目(IRT0540);食品科学与技术国家重点实验室目标导向资助项目(SKLF-MB-200806)
张媛媛(1983—),女,博士研究生,研究方向为食品科学。E-mail:zhyy2009@yahoo.com.cn
*通信作者:谢明勇(1957—),男,教授,博士,研究方向为食品化学、食品营养与安全及天然产物分离与应用。E-mail:myxie@ncu.edu.cn



