栗 娜,籍保平,*,李 博,吴 薇
(1.中国农业大学食品科学与营养工程学院,北京 100083;2.中国农业大学工学院,北京 100083)
可降解咖啡碱菌株的筛选与鉴定
栗 娜1,籍保平1,*,李 博1,吴 薇2
(1.中国农业大学食品科学与营养工程学院,北京 100083;2.中国农业大学工学院,北京 100083)
目的:筛选能够降解咖啡碱的细菌,以期在该毒素的生物脱毒中得到应用。方法:以咖啡碱作为唯一碳源和氮源进行咖啡碱降解菌株的初筛,之后将初筛的10株菌通过液体培养基咖啡碱降解实验最终筛选出降解能力最强的1株菌。结果:筛选出的HZ-1菌株在48h即可将咖啡碱完全降解,对目标菌株细胞形态、生理生化以及16SrDNA进行鉴定,确定该菌株为Pseudomonas lutea,属于假单胞菌属。结论:利用咖啡碱作为唯一碳源和氮源从土壤中筛选出降解咖啡碱良好的菌株,为脱除咖啡碱提供了微生物菌种,填补了国内空白。
咖啡碱;假单胞菌;筛选;鉴定
Abstract:Objective:The aim of this work was to find strains capable of degrading caffeine so as to develop a biological approach for caffeine detoxicification. Method:The preliminary screening of target strains was performed using caffeine as both carbon and nitrogen sources, and then the ten screened strains were further screened by evaluating their abilities to degrade caffeine in liquid medium after culture. As a result, a strain with the strongest ability to degrade caffeine was obtained and named HZ-1.After 48 h culture of HZ-1, caffeine in liquid medium was completely degraded. Based on the morphological, physiological and biochemical properties and 16 rDNA gene sequence, this strain was identified asPseudomonas lutea. To the best of our knowledge,this is the first report on the biological degradation of caffeine at home.
Key words:caffeine;Pseudomonas lutea;screening;identification
咖啡碱(caffeine)又名咖啡因,是一种嘌呤类生物碱,主要分布在咖啡豆、茶叶以及日常饮料中[1-3]。研究表明,高剂量的摄入咖啡碱会影响睡眠,增加血压,引起头疼、烦躁、焦虑、易怒、胎儿早产及精细运动功能受损,因此低咖啡因产品越来越受到消费者的欢迎[4-7]。目前脱咖啡碱技术主要有水脱除法[8]、溶剂萃取法[9]、吸附分离法[10]、超临界CO2萃取法[11]以及微生物法[12],前几种方法脱除率不高且费时费力,还有可能造成环境污染,而微生物法因其降解效率高、安全无毒等优点得到了越来越多学者的青睐。20世纪70年代早期,就有利用细菌把咖啡碱作为有毒物质降解的报道,这是关于微生物降解咖啡碱的最早研究[13]。后来Gokulakrishnan等[14]从土壤中筛选出Pseudomonassp. GSC 1182菌株可以利用咖啡碱作为唯一碳源和氮源,该菌株在48h内就可以降解掉基础培养基中80%的咖啡碱,而加入5g/L的蔗糖可以使菌株在36~40h内的降解率达到100%。Brand等[15]发现曲霉菌和青霉菌等真菌类微生物在25℃下可100%降解咖啡碱,而在30℃下其降解效率却只有30%。目前,在关于微生物法降解咖啡碱的研究方面,欧美以及日本和印度等国家均取得了进展,但是我国微生物降解咖啡碱方面尚属空白。本研究旨在使用安全、特异性高的方法高效筛选出降解咖啡碱的菌株并对其进行鉴定,为脱除咖啡碱提供微生物菌种,以填补国内空白。
1 材料与方法
1.1 材料与试剂
从杭州茶园、云南茶园、福建茶园和湖北茶园分别收集不同深度的土壤样品(0、15、30cm)共12份。
咖啡碱标准品(纯度不低于99%) 天津市光复精细化工研究所;细菌DNAout试剂盒 Azygen公司。
咖啡碱液体筛选培养基(g/L)[14]:Na2HPO40.12、K2HPO41.3、MgSO4·7H2O、CaCl20.3、咖啡碱1.2、pH5.5,121℃,灭菌15min;咖啡碱固体筛选培养基:在MHA培养基(牛肉浸粉5g/L、酪蛋白水解物17.5g/L、淀粉1.5g/L、琼脂12.5g/L)上添加咖啡碱1.2g/L,121℃,灭菌15min。
1.2 仪器与设备
Citra6紫外-可见分光光度计 澳大利亚GBC公司。
1.3 方法
1.3.1 降解咖啡碱菌株的分离纯化和初筛
无菌操作方法称取1g土壤样品,加入到含50mL无菌咖啡碱液体筛选培养基的250mL三角瓶中,摇匀,30℃摇床培养,调整转速为180r/min,培养48~72h。培养液于3000×g离心30min,取2.5mL上清液,加入到50mL无菌咖啡碱液体筛选培养基里培养,为避免细菌原环境中的碳源干扰,共需3次转接培养。3代培养后,取0.5mL菌液用无菌水梯度稀释,稀释级数为10-1、10-2、10-3、10-4、10-5,采用咖啡碱固体筛选培养基进行基内接种,稀释涂布法,每个稀释度做3个平行,两次重复,30℃倒置培养。菌落长出后,挑取单菌落在固体筛选培养基平板上划线分离,30℃倒置培养24~36h。挑取单菌落进行革兰氏染色,镜检无杂菌后,转接在菌种保存培养基制成的斜面上培养,30℃培养24~36h,于4℃冰箱保存。将纯化的菌株分别接种咖啡碱液体筛选培养基中,30℃,180r/min摇床培养48h,比较其OD600nm菌体生长量,初步筛选出可利用咖啡碱的菌株。
1.3.2 降解咖啡碱菌株的复筛
将初筛得到的10株菌分别接种于种子培养基中,30℃,180r/min培养12h,调整种子液的菌数为108CFU/mL,以2%的接种量接到液体发酵培养基中,30℃,180r/min培养48h,以不接种的空白组作为对照。发酵前后培养液在3000×g离心30min,取上清液在波长273nm处测定其紫外吸收值,根据吸光度查咖啡碱标准曲线,对发酵前后咖啡碱的含量进行测定和比较。计算各菌株的咖啡碱降解率,筛选出降解能力最强的1株菌。
1.3.3 发酵液中咖啡碱含量的测定
咖啡碱标准曲线的绘制:吸取0、1、2、3、4、5、6mL咖啡碱标准液于25mL容量瓶,加水稀释至刻度,混匀,每个浓度分别作3个平行。用10mm石英比色皿,在波长273nm处,以试剂空白作参比,测定吸光度。将测得的吸光度与对应的咖啡碱质量浓度绘制标准曲线,得回归方程为y=50.0673x-0.0006,R2=0.9999。
咖啡碱降解率采用以下公式计算:
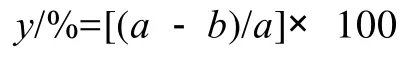
式中:a为初始咖啡碱质量浓度/(g/L);b为剩余咖啡碱质量浓度/(g/L);y为咖啡碱降解率/%。
1.3.4 菌株的鉴定
菌落及菌株形态观察:在MHA培养基平板上30℃培养36h后观察菌落形态、色泽,革兰氏染色,在显微镜下观察细胞形状。
生理生化性质的测定[16]:主要是惟一碳源、接触酶、氧化酶、过氧化氢酶、卵磷脂降解、硝酸盐还原和温度耐受等实验。
细菌16S rDNA 基因序列测定:1)基因组DNA 的提取。使用AXYGEN细菌基因组DNA小量试剂盒提取菌株全基因组DNA;2)16S rDNA纯化、扩增、测序,引物:27f:5'-AGAGTTTGATCCTGGCTCAG-3';1492r:5'-AAGGAGGTGATCCAGCCGCA-3',纯化、扩增、测序由北京华大基因有限责任公司完成;3)数据处理。测序结果在NCBI 使用Blast 比对,从GenBank数据库中获得与菌株16S rDNA 同源的公认标准序列数据,使用Clustal X 1.8 对齐后使用MEGA 2.1 计算序列相似性并作系统发育分析。
2 结果与分析
2.1 降解咖啡碱菌株的初筛

表1 降解咖啡碱菌株的初筛结果Table 1 Results of preliminary screening for strains capable of degrading caffeine
通过初筛得到10株菌,能在以咖啡碱为唯一碳源和氮源的培养基中良好生长(表1)。其中有6株来源于表层土壤(0cm),4株来源于中层土壤(15cm),而深层土壤中没有筛选出可以降解咖啡碱的菌株。这说明降解咖啡碱的菌株多存在于接近表层的土壤,多为好氧菌。同时发现,HZ-1以及FJ-2菌株的生长速度较快,说明这两株菌株利用咖啡碱能力较强,细胞可以活跃的进行生长繁殖的代谢。
2.2 降解咖啡碱菌株的复筛
将初筛得到的10株具有咖啡碱降解能力的菌株分别接种于种子培养基中发酵培养12h,然后分别以2%的接种量接到咖啡碱液体发酵培养基中培养48h,做两个重复,同时以不接种的空白组作为对照。取发酵前后培养液的上清液用紫外分光光度计测定咖啡碱的剩余量,从而计算各菌株的咖啡碱降解率,发现HZ-1菌株的降解能力最强(表2)。对比表1与表2可以看出,菌株降解咖啡碱的量基本与菌液的OD600nm成正比,即菌液的OD600nm值越高,菌体生长旺盛,咖啡碱的降解量就越大,降解效率越高,反之亦然。实验最后筛选出HZ-1的降解能力最强,菌株在48h就将咖啡碱完全降解,降解率达到100%。
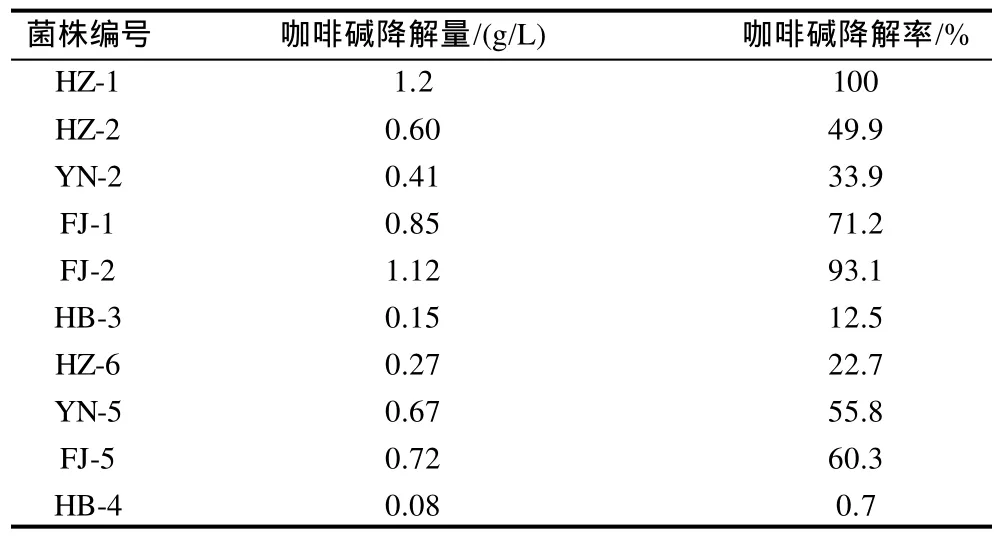
表2 降解咖啡碱菌株的复筛结果Table 2 Results of repeated screening for strains capable of degrading caffeine
2.3 菌株的鉴定
在MHA培养基上涂布HZ-1菌株,于30℃培养24h,菌株生长良好,菌落形态如图2所示,HZ-1菌株为黄色圆形菌落,生长直径0.5mm左右,菌落边缘整齐,凸起,不透明,表面湿润光滑。将菌株在MHA培养基30℃培养24h,挑选生长良好的单菌落涂片革兰氏染色观察,菌体细胞形态如图3所示,显微镜下细胞形态为细小短杆状,革兰氏染色阴性。
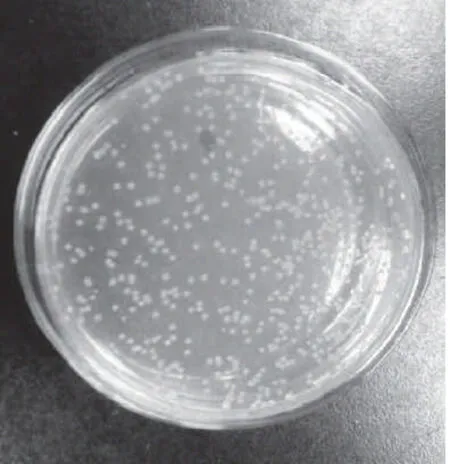
图2 HZ-1菌株菌落形态Fig.2 Colony morphology of strain HZ-1
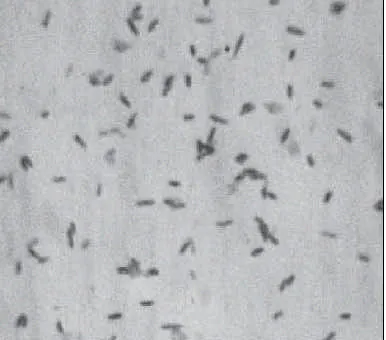
图3 HZ-1菌株形态Fig.3 Cell morphology of strain HZ-1
对HZ-1菌株进行了部分生理生化特征测定,结果表明该菌能利用葡萄糖、蔗糖和果糖等作为碳源,过氧化氢酶阳性,氧化酶阴性(表3)。参照文献[17]对革兰氏阴性好氧菌的阐述并结合前面对HZ-1菌株细胞形态的观察,以及Peix等[18]于对Pseudomonas lutea的描述,初步确定HZ-1菌株属于假单胞菌属。
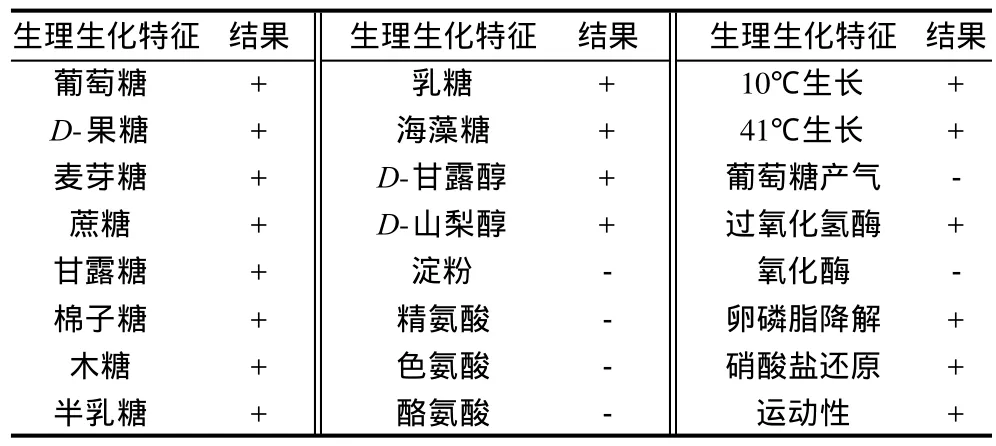
表3 HZ-1菌株生理生化实验结果Table 3 Physiological and biochemical properties of strain HZ-1
HZ-1菌株的16S rDNA 在NCBI 使用Blast 比对,结果表明HZ-1菌株与Pseudomonas lutea同源性最高,同源性99%。从GenBank 数据库中获得与菌株16SrDNA同源的公认标准序列数据进行系统发育分析(图3),结合遗传距离、形态特征以及生理生化特征,可以确定HZ-1为Pseudomonas lutea,属于假单胞菌属。

图4 HZ-1菌株系统发育树Fig.4 Phylogenetic tree based on the 16S rDNA gene sequence of strain HZ-1
3 结 论
以咖啡碱作为唯一碳源和氮源进行初筛、复筛,通过测定对咖啡碱的降解能力,最终获得降解效果最佳的HZ-1菌株,该菌株在48h降解率为100%。通过菌株形态观察、生理生化指标分析、16S rDNA测序鉴定确定HZ-1菌株为Pseudomonas lutea,相比目前国际上已报道的菌株具有良好的降解效果,为微生物法降解食品中的咖啡碱提供了参考。
[1] MARTIN M J, PABLOS F, GONZALEZ A G. Discrimination between arabica and robusta green coffee varieties according to their chemical composition[J]. Talanta, 1998, 46(6):1259-1264.
[2] SILVAROLLA M B, MAZZAFERA P, LIMA M M A. Caffeine content of EthiopianCoffea arabicabeans[J]. Genet Mol Biol, 2000, 23:213-215.
[3] CAUDLE A G, BELL L N. Caffeine and theobromine content of ready to eat chocolate cereals[J]. J Am Diet Assoc, 2000, 100:690-692.
[4] LANDOLT H P, DIJK D J, GAUSS S E, et al. Caffeine reduces lowfrequency delta activity in the human sleep EEG[J].Neuropsychopharmacol, 1995, 12:229-238.
[5] SHILO L, SABBAH H, HADARI R, et al. The effects of coffee consumption on sleep and melatonin secretion[J]. Sleep Med, 2002, 3(3):271-273.
[6] BUERGE I J, POIGER T, MULLER M D, et al. Caffeine, an anthropogenic marker for wastewater contamination of surface waters[J]. Environ Sci Technol, 2003, 37:691-700.
[7] FERNANDES O, SABHARWAL M, SMILEY T, et al. Moderate to heavy caffeine consumption during pregnancy and relationship to spontaneous abortion and abnormal fetal growth[J]. A Meta-analysis Reprod Toxicol, 1998, 12:435-444.
[8] FELEMAN J R, KATZ S N. Caffeine[M]//McKETTA J J. Encyclopedia of chemical processing and design. New York:Marcel Dekker Inc, 1977:424-440.
[9] 周志, 汪兴平, 莫开菊, 等. 茶叶咖啡加分离提取新技术研究[J]. 食品科学, 2002, 23(8):105-107.
[10] 大须博文, 竹尾忠一. 用柱层层析除去乌龙茶浸出液的咖啡碱[J]. 广东茶叶, 1991, 34:43-45.
[11] 周海滨, 宋新生. 超临界CO2脱除茶叶咖啡碱的工艺优化研究[J]. 食品科学, 2003, 24(5):88-91.
[12] BLECHER R, LINGENS F. Metabolism of caffeine byPseudomonas putida[J]. Hoppe Seylers Z Physiol Chem, 1977, 358(7):807-817.
[13] WOOLFOLK C A. Metabolism of M-methylpurines by aPseudomonas putidastrain isolated by enrichment on caffeine as the sole source of carbon and nitrogen[J]. J Bacteriol, 1975, 123:1088-1106.
[14] GOKULAKRISHNAN S, CHANDRARAJ K, GUMMADI S, et al. A preliminary study of caffeine degradation byPseudomonassp. GSC 1182[J]. International Journal of Food Microbiology , 2007, 113:346-350.
[15] BRAND D, PANDEY A, ROUSSOS S, et al. Biological detoxification of coffee husk by filamentous fungi using a solid-state fermentation system[J]. Enzyme Microb Technol, 2000, 27:127-133.
[16] 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京:科学出版社, 2001:364-399.
[17] GARRITY G M, BELL J A, LILBURNT G. 伯杰氏细菌鉴定手册[M]. 中国科学院微生物研究所伯杰氏细菌鉴定手册翻译组, 译. 9版. 北京:科学出版社, 1994:274-313.
[18] PEIX A, RIVAS R, SANTAREINA I, et al.Pseudomonas luteasp.nov., a novel phosphate-solubilizing bacterium isolated from the rhizosphere of grasses[J]. International Journal of Systematic and Evolutionary Microbiology, 2004, 54(3):847-850.
Screening and Identification of aPseudomonas luteaStrain Capable of Degrading Caffeine
LI Na1,JI Bao-ping1,*,LI Bo1,WU Wei2
(1. College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China;2. College of Engineering, China Agricultural University, Beijing 100083,China)
TS201.3
A
1002-6630(2010)21-0218-04
2010-04-19
“十一五”国家科技支撑计划项目(2006BAD05A06-Z01)
栗娜(1985—),女,硕士研究生,研究方向为功能食品。E-mail:lina8575@gmail.com
*通信作者:籍保平(1958—),男,教授,硕士,研究方向为功能食品。E-mail:jbp@cau.edu.cn



