邹 祥,郭 霞,, 孙 敏
(1.西南大学药学院,重庆 400715;2.西南大学生命科学学院,重庆 400715)
前体对桑黄菌丝生长和胞外多糖合成的影响
邹 祥1,郭 霞1,2, 孙 敏2
(1.西南大学药学院,重庆 400715;2.西南大学生命科学学院,重庆 400715)
考察不同类型前体对桑黄菌丝生长和胞外多糖合成的影响,在全合成培养基中添加乳糖前体有利于桑黄菌丝的生长和胞外多糖的合成。采用正交试验优化获得乳糖补加条件:发酵初始补加30g/L乳糖,3L发酵罐发酵168h验证实验获得的桑黄菌丝量最高可达13.18g/L,胞外多糖产量最高可达1.21g/L,比对照组提高了25%。而植物油类前体筛选发现菜籽油能明显促进桑黄菌丝的生长,7L发酵罐中发酵144h桑黄菌丝量最高可达23.77g/L,比对照组提高了207.1%,但抑制胞外多糖的合成。
前体;桑黄;菌丝生长;胞外多糖
Abstract:To promote mycelium growth and polysaccharide biosynthesis inPhellinus igniarius, different groups (sugar and plant oil) of precursors were added to synthetic complete medium and the effects of the kind and amount of separately added sugars and plant oils onPhellinus igniariusmycelium growth and polysaccharide biosynthesis were dealt with. A two-factor, threelevel full combination design was used to optimize the conditions for lactose supplement, and the results showed that a maximum mycelium biomass of up to 13.18 g/L and a maximum polysaccharide production of up to 1.21 g/L were achieved after 168 h fermentation in a 3 L fermentor with an initial lactose concentration of 30 g/L, and the increment percent of polysaccharide production was 25% in comparison with the control. Among oils from three plants, including soybean, olive and rapeseed,rapeseed oil most obviously promoted the growth ofPhellinus igniariusmycelia, and the maximum mycelium biomass was up to 23.77 g/L after fermentation for 144 h in a 7 L fermentor, 207.1% higher than that obtained from the control, while polysaccharide biosynthesis was inhibited by adding rapeseed oil.
Key words:precursors;Phellinus igniarius;mycelia growth;polysaccharide
桑黄(Phellinus igniarius)学名为火木针层孔菌,是一种珍稀的药用真菌。桑黄具有多种药理活性,其中活性成分桑黄多糖具有较强的抗癌[1]、抗氧化[2]及降血脂[3]等功效,并且无毒副作用,具有较高的经济价值。由于桑黄野生子实体稀少,人工栽培还处于起步阶段,采用液体培养获得具有药理活性的菌丝体和胞外多糖,周期短,便于工业化生产,具有广泛的市场前景。
发酵法生产桑黄菌丝体及多糖已有相关的报道,主要集中在发酵培养基优化、工艺条件、分离纯化等[4-6]方面,而且优化的培养基多以复合的碳、氮源为主、成分复杂,对多糖的测定和代谢调控的研究带来困难。针对此问题,本课题组开展了桑黄发酵全合成培养基筛选与优化的研究,筛选得到成分清晰,多糖测定简便的培养基[4]。同时由于真菌多糖为不同糖单元组成的多聚糖大分子,多糖分子结构往往影响其生物活性[7]。在发酵过程中,改变多糖生物合成的代谢流量和糖单元分子的供应,对多糖合成及分子结构具有显着的影响。因此,基于前期筛选得到的全合成培养基,开展不同类型前体的筛选与发酵罐流加实验研究,为进一步研究桑黄多糖的生物合成代谢调控规律提供参考。
1 材料与方法
1.1 菌种
桑黄菌种(P. igniariusNO.5.51) 购于中国普通微生物菌种保藏管理中心(CGMCC)。
1.2 培养基
种子培养基(g/L):葡萄糖30.0、酵母粉15.0、MgSO4·7H2O 1.0、KH2PO41.0、CaCO30.2、pH6.1。全合成培养基:参照文献[4]配制。
1.3 培养方法
1.3.1 摇瓶培养
250mL摇瓶,全合成培养基装液量50mL,接种量10%,温度25℃,摇床转速200r/min。
1.3.2 3L发酵罐培养
3L发酵罐(上海保兴生物设备公司),装料2L,接种量10%,培养温度25℃,起始转速200r/min,发酵过程测定还原糖、生物量、胞外多糖代谢参数。
1.3.3 7L发酵罐培养
7L发酵罐(上海保兴生物设备公司),装料5L,接种量10%,培养温度25℃,起始转速200r/min,发酵过程测定还原糖、生物量、胞外多糖代谢参数。
1.4 不同前体种类筛选
1.4.1 糖类的筛选
以全合成培养基为基础,分别加入质量分数为1%的甘露糖、葡萄糖、阿拉伯糖、蔗糖、半乳糖和乳糖。研究不同糖对桑黄菌丝生长和胞外多糖产量的影响,结果取3批实验数据平均值。
1.4.2 植物油的筛选
以全合成培养基为基础,分别加入质量分数为1%的黄豆油、橄榄油和菜籽油,研究不同种类的油对桑黄菌丝生长和胞外多糖产量的影响,结果取3批实验数据平均值。
1.5 分析方法
1.5.1 生物量测定
取20mL发酵液,3000r/min离心10min,得菌体,洗涤两次,菌丝体于80℃ 烘干并称质量。
1.5.2 还原糖的测定
DNS 法测定[8]。
1.5.3 胞外多糖产量测定[4]
取20mL发酵液,3000r/min离心10min后,向上清液中加入2~3倍体积的乙醇,得到沉淀,于80℃烘干至质量恒定。
2 结果与分析
2.1 糖类前体对桑黄菌丝生长和胞外多糖合成的影响
药用真菌多糖的合成主要通过糖苷键将不同的糖单体连接形成大分子多聚体结构,因此不同糖单体结构会影响多糖分子合成的结构和产量。本实验选择单糖(甘露糖、葡萄糖、阿拉伯糖和半乳糖)和双糖(蔗糖和乳糖),分别考察不同糖类化合物对桑黄菌丝生长和胞外多糖合成的影响,结果见表1。
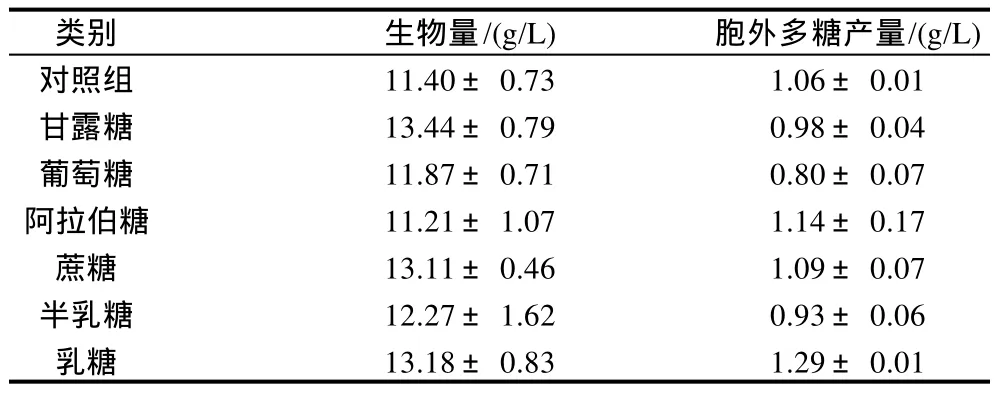
表1 不同糖种类对桑黄菌丝生长和胞外多糖合成的影响Table 1 Effects of the type and amount of sugar on mycelium growth and polysaccharide biosynthesis
由表1可见,和对照组相比,添加甘露糖、蔗糖、乳糖有利于桑黄菌丝生长,其中乳糖获得的桑黄菌丝生物量最高可达(13.18±0.83)g/L,比对照组提高了15.6%。而对桑黄胞外多糖合成的影响和对照组相比,添加阿拉伯糖和乳糖有助于胞外多糖的合成,其中添加乳糖时,桑黄胞外多糖产量可达(1.29±0.01)g/L,比对照组提高了21.7%。
2.2 油类前体对桑黄菌丝生长和胞外多糖合成的影响
植物油在发酵过程中往往作为前体供应和起消泡作用,同时由于油脂利用无阻遏效应,不易发生降解物的阻遏效应,有利于次级代谢产物合成,往往作为前体应用于众多抗生素发酵生产。但油脂是否对桑黄胞外多糖的合成产生影响,迄今没见相关报道,因此,本实验选择几种不同的植物油考察对桑黄菌丝生长和胞外多糖合成的影响,结果如表2。
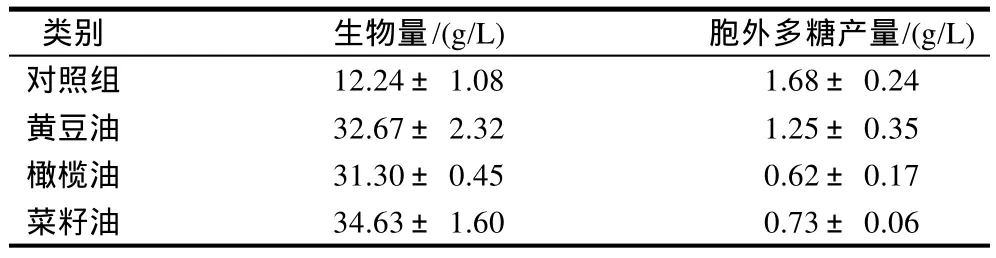
表2 不同植物油对桑黄菌丝生长和胞外多糖合成的影响Table 2 Effects of the type and amount of sugar on mycelium growth and polysaccharide biosynthesis
由表2可知,和对照组相比,添加不同的植物油均能较大幅度提高桑黄菌丝的生长,其中添加菜籽油生物量最高可达(34.63±1.6)g/L,比对照组提高了182.9%。然而胞外多糖明显低于对照组,可能原因在于由于植物油起到消泡作用,同时发酵菌丝黏度增长迅速,摇瓶中溶氧浓度受到限制,影响了胞外多糖的合成。Hsieh等[9]在5L发酵罐中发现添加橄榄油,提高溶氧浓度条件下,明显有利于灰树花菌丝生长和多糖的合成。
2.3 正交试验优化乳糖添加浓度和时间
由于添加乳糖明显有利于桑黄菌丝生长和胞外多糖的合成,根据桑黄多糖合成的特点,选择不同乳糖质量浓度(10、20、30g/L)和添加时间(0、72、120h)进行代谢强化,采用正交试验进行优化,结果见表3。
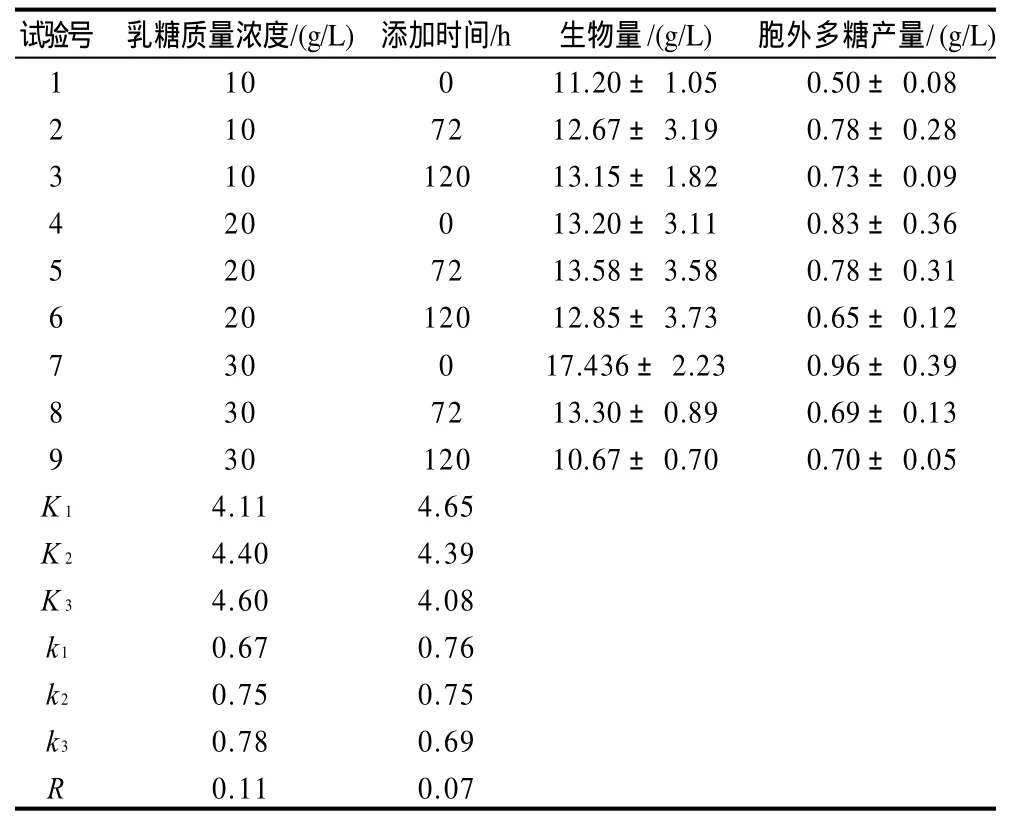
表3 乳糖质量浓度和添加时间对桑黄菌丝生长和胞外多糖合成影响的正交试验结果Table 3 Experimental results of optimizing conditions for lactose supplement
由表3极差分析R值可知,最优的组合为发酵初始(0h)添加30g/L的乳糖,可以获得最多的桑黄菌丝量和胞外多糖。通过验证实验,发酵初始添加30g/L乳糖后,胞外多糖产量为(1.47±0.02)g/L,对照组为(1.06±0.01)g/L,表明正交试验优化结果可信。从表4方差分析可知,乳糖添加时间对桑黄多糖的合成影响最显着。
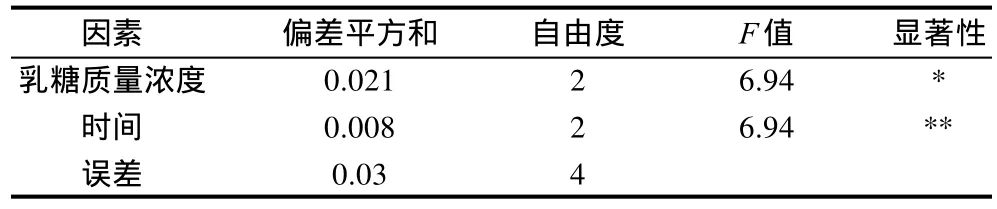
表4 正交试验结果方差分析表Table 4 Analysis of variances for polysaccharide production with various conditions for lactose supplement
2.4 3L发酵罐乳糖补加发酵实验
进一步在3L发酵罐中考察初始培养基中添加30g/L乳糖对桑黄发酵过程的影响,结果如图1。
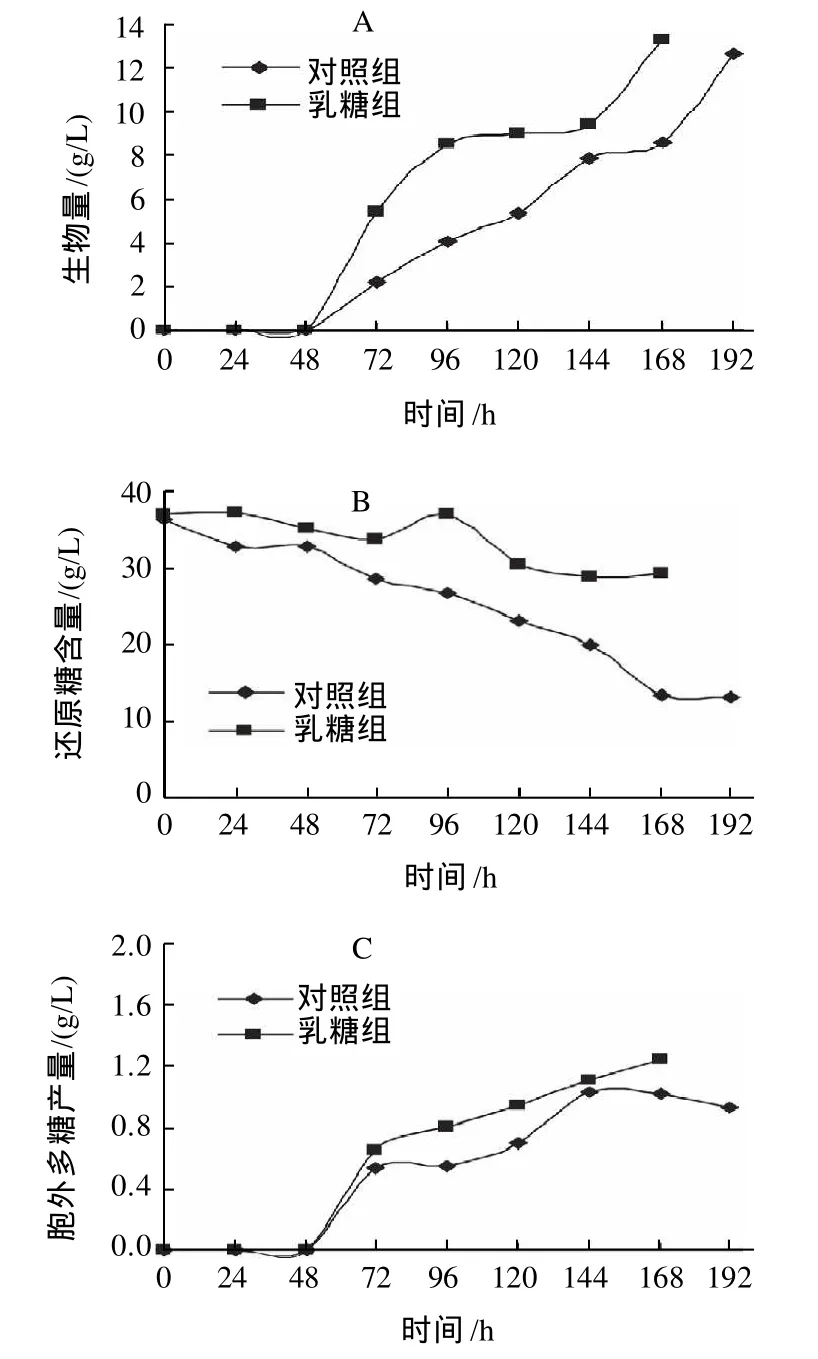
图1 3L发酵罐初始补加乳糖对桑黄发酵过程的影响Fig.1 Effect of adding lactose on mycelium biomass, reducing sugar consumption and polysaccharide production during fermentation in a 3 L fermentor
从图1可知,和对照组相比,补加乳糖48h后,桑黄菌丝体生长明显加快, 168h时桑黄菌丝生物量最高可达13.18g/L;从糖的利用来看, 对照组还原糖含量从发酵初到发酵结束时,质量浓度维持在37~15g/L之间,而补加乳糖组,还原糖含量维持在37~30g/L之间,说明乳糖被桑黄菌丝分解为葡萄糖和半乳糖,参与了胞外多糖的合成;168h时桑黄胞外多糖最高可达1.21g/L,和对照组相比提高了25%。
2.5 7L发酵罐菜籽油流加实验
根据摇瓶结果,进一步在7L发酵罐中开展初始补加菜籽油的发酵实验,结果如图2所示。
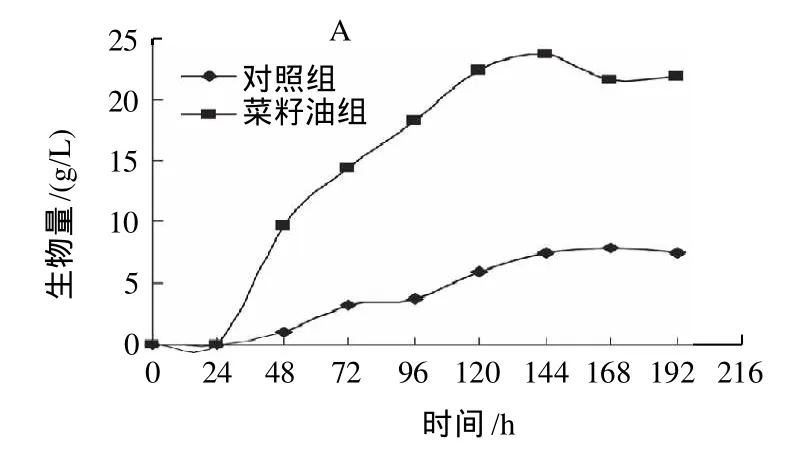
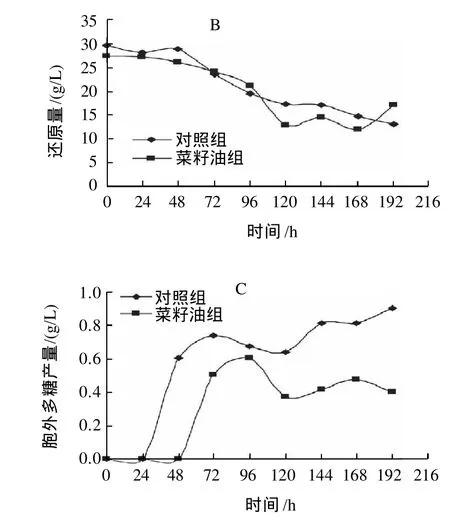
图2 7L发酵罐初始补加菜籽油对桑黄发酵过程的影响Fig.2 Effect of adding rapeseed oil on mycelium biomass, reducing sugar consumption and polysaccharide production during fermentation in a 7 L fermentor
由图2可见,补加10g/L的菜籽油发酵24h后,桑黄菌丝生长明显高于对照组,144h桑黄菌丝生物量最高可达23.77g/L,相比对照组提高了207.1%。从还原糖的利用看,发酵96h 前,两组菌体对还原糖的消耗基本相近,说明可能分解利用菜籽油的脂肪酸用于细胞生长;而胞外多糖的合成和摇瓶结果相似,补加菜籽油后胞外多糖的合成明显低于对照组,发酵过程在线溶氧浓度监测显示溶解氧(DO)浓度长时间低于10%,同时菌体浓度增加,发酵液黏度明显增加,形成的氧限制状态有可能是胞外多糖合成量减少的主要原因。
3 讨论与结论
随着桑黄液体培养技术的发展,提高桑黄有效活性成分多糖组分的产量和药理活性是实现药用真菌资源高值化利用的关键[10],然而由于药用多糖分子的复杂性和多样性,采用微生物代谢调控手段提高药用真菌代谢产物的生物合成受到重视。如Liang等[11]利用苯巴比妥诱导促进药用真菌灵芝菌合成灵芝酸,同时对生物合成途径重点关键基因进行了转录水平分析;Zhu等[12]利用真菌来源的生物诱导子诱导灵芝多糖和灵芝酸的合成。本课题组曾利用不同植物激素诱导桑黄多糖的合成,发现萘乙酸能促进桑黄菌丝生长和多糖的合成,同时对多糖的分子结构没有影响[6];同时发现用NaCl溶液调节桑黄发酵过程的渗透压,桑黄多糖的分子组成发生变化[13],相类似的现象也被台湾学者在桑黄研究中进一步报道[14]。本研究从多糖合成前体供应的角度,在全合成培养基的基础上,通过筛选不同的糖类前体和植物油前体,考察对桑黄菌丝生长和胞外多糖合成的影响。结果表明乳糖作为前体,能明显促进桑黄菌丝生长和胞外多糖的合成,3L发酵罐初始添加乳糖发酵168h时胞外多糖最高可达1.21g/L,比对照组提高了25%,说明增加多糖合成单元的供应策略是可行的。植物油的添加能促进药用真菌的生理代谢,可作为一种有效的调控手段,在药用真菌灵芝菌发酵过程,添加玉米油能促进菌丝生长和多糖的合成[15]。而在本实验中,补加菜籽油,能明显大幅度提高桑黄菌丝体的生长;同时由于菌丝大量生长,造成发酵过程氧供应受到限制,影响胞外多糖合成,还需要进一步增加搅拌供氧措施来解决。上述研究结果将为进一步应用液体发酵技术培养桑黄菌丝体和胞外多糖,以及真菌多糖合成的代谢调控提供新的研究思路。
[1] DONG Wei, NING Li, LU Weidong, et al. Tumor-inhibitory and liverprotective effects ofPhellinus igniariusextracellular polysaccharides[J].World Journal of Microbiology & Biotechnology, 2009, 25(4):633-638.
[2] LUNG M Y, TSAI J C. Antioxidant properties of polysaccharides from the willow bracket medicinal mushroom,Phellinus igniarius(L.) Quel.(aphyllophoromycetideae) in submerged culture[J]. International Journal of Medicinal Mushrooms, 2009, 11(4):383-394.
[3] ZOU Xiang, GUO Xia, SUN Min. pH control strategy in a shaken minibioreactor for polysaccharide production by medicinal mushroomPhellinus linteusand its anti-hyperlipemia activity[J]. Bioprocess and Biosystems Engineering, 2009, 32(2):277-281.
[4] GUO Xia, ZOU Xiang, SUN Min. Optimization of a chemically defined medium for mycelial growth and polysaccharide production by medicinal mushroomPhellinus igniarius[J]. World Journal of Microbiology& Biotechnology, 2009, 25(12):2187-2193.
[5] GUO Xia, ZOU Xiang, SUN Min. Optimization of extraction process by response surface methodology and preliminary characterization of polysaccharides fromPhellinus igniarius[J]. Carbohydrate Polymers, 2010, 80(2):344-349.
[6] GUO Xia, ZOU Xiang, SUN Min. Effects of phytohormones on mycelial growth and exopolysaccharide biosynthesis of medicinal mushroomPellinus linteus[J]. Bioprocess and Biosystems Engineering, 2009, 32(5):701-707.
[7] WU Mingjiang, JIANG Dezhi, LIU Tiemei, et al. Structural analysis of water-soluble polysaccharide PIP1 extracted from the cultured mycelium ofPhellinus igniarius[J]. Chemical Research in Chinese Universities,2006, 22(6):708-711.
[8] 北大生化系生化教研室. 生物化学实验指导[M]. 北京:高等教育出版社, 1986:34-36.
[9] HSIEH C, LIU C J, TSENG MH, et al. Effect of olive oil on the production of mycelial biomass and polysaccharides ofGrifola frondosaunder high oxygen concentration aeration[J]. Enzyme Microbiology Technology, 2006, 39(3):434-439.
[10] ZHU Tongbo, KIM S H, CHEN Changyan. A medicinal mushroom:Phellinus Linteus[J]. Current Medicinal Chemistry, 2008, 15(13):1330-1335.
[11] LIANG CX, LI YB, XU JW, et al. Enhanced biosynthetic gene expressions and production of ganoderic acids in static liquid culture ofGanoderma lucidumunder phenobarbital induction[J]. Applied Microbiology and Biotechnology, 2010, 86(5):1367-1374.
[12] ZHU Liwen, ZHONG Jianjiang, TANG Yajie. Significance of fungal elicitors on the production of ganoderic acid andGanodermapolysaccharides by the submerged culture of medicinal mushroomGanoderma lucidum[J]. Process Biochemistry, 2008, 43(12):1359-1370.
[13] ZOU Xiang, SUN Min, GUO Xia. Quantitative response of cell growth and polysaccharide biosynthesis by the medicinal mushroomPhellinus linteusto NaCl in the medium[J]. World Journal of Microbiology &Biotechnology, 2006, 22(11):1129-1133.
[14] SHU C H, HSU H J. Effects of sodium chloride on the production of bioactive exopolysaccharides in submerged cultures ofPhellinus linteus[J]. Journal of Chemical Technology and Biotechnology, 2008, 83(5):618-624.
[15] HUANG H C, CHEN C I, HUNG C N, et al. Experimental analysis of the oil addition effect on mycelia and polysaccharide productions inGanoderma lucidumsubmerged culture[J]. Bioprocess and Biosystems Engineering, 2009, 32(2):217-224.
Effect of Precursors on Mycelium Growth and Polysaccharide Biosynthesis in Medicinal MushroomPhellinus igniarius
ZOU Xiang1,GUO Xia1,2,SUN Min2
(1. College of Pharmaceutical Sciences, Southwest University, Chongqing 400715, China;2. School of Life Sciences, Southwest University, Chongqing 400715, China)
Q815
A
1002-6630(2010)21-0262-04
2010-08-19
重庆市自然科学基金项目(CSTC,2005BB1101 );重庆市科技创新能力建设项目(CSTC,2009CB1010)
邹祥(1976—),男,副教授,博士,研究方向为发酵工程与食品生物技术。E-mail:zhx1030@yahoo.cn



