黎 超,毛超伦,雍克岚*
(上海大学生命科学学院,上海 200444)
肉桂原花青素的提取及其对高级糖基化终产物形成的抑制作用
黎 超,毛超伦,雍克岚*
(上海大学生命科学学院,上海 200444)
通过单因素和正交试验确定肉桂中原花青素(proanthocyanidins of cinnamon,CPAs)最佳水提工艺条件,比较9种大孔吸附树脂对CPAs的吸附与解吸性能,对CPAs进行体外蛋白非酶糖化抑制实验。结果表明:最佳提取条件为液料比14:1(mL/g)、提取温度60℃、pH5.0、提取时间2h,CPAs提取得率为14.27mg/g,LSA-21大孔吸附树脂分离纯化CPAs效果最佳。该肉桂提取物对高级糖基化终产物的形成具有很好的抑制活性,其IC50为45.93 μg/mL,高于阳性对照氨基胍。
肉桂;原花青素;大孔树脂;高级糖基化终产物
肉桂为樟科樟属常绿乔木肉桂的干燥树皮,是一种药食两用植物资源。肉桂原花青素含量丰富,居98种常见食物原料之首[1],高于葡萄籽。原花青素是由儿茶素或表儿茶素通过C4-C6或C4-C8聚合而成的一大类酚类聚合物,是一类植物体次级代谢产物,因其显着的抗氧化、清除自由基性质而对心血管疾病的预防以及增强免疫、抗炎、抗癌等具有较好作用[2]。我国肉桂产量占世界的80%以上[3],因此从肉桂中提取原花青素具有很好的前景。
高级糖基化终产物(advanced glycation endproducts,AGEs)是指还原糖与蛋白质、脂质或核酸的氨基基团发生非酶促反应形成的一类复杂的不可逆聚合物[4]。现代研究证实AGEs在糖尿病并发症的发病机制中起着重要作用,AGEs在体内的蓄积能诱发糖尿病肾病、白内障、神经病变[5-6]以及动脉硬化[7]和Alzheimer,s病[8-9]等。这些严重的糖尿病并发症是导致糖尿病患者致残、致死的主要原因。因此筛选开发AGEs形成的抑制剂,对于预防和治疗糖尿病并发症,有重要意义。
迄今为止,关于肉桂抗AGEs形成的研究鲜有报道。本实验对肉桂原花青素提取工艺优化及其抗AGES形成抑制活性进行研究,为肉桂的开发利用提供参考。
1 材料与方法
1.1 材料与试剂
肉桂 广东省高要市;(+)-儿茶素(含量≥99%) 中国药品生物制品检定所;氨基胍盐酸盐 美国Sigma公司;NaN3美国Ameresco公司;牛血清白蛋白(BSA)北京鼎国生物技术有限公司;AB-8、ADS-17、ADS-21大孔树脂 天津南开和成科技有限公司;D-101、LSA-10、LSA-21、LSA-40、XDA-1大孔树脂 西安蓝晓科技有限公司;HP-20树脂 日本三菱化学公司。其他化学试剂均为国药集团化学试剂有限公司分析纯试剂。
1.2 仪器与设备
LS-55型荧光分光光度计 美国PerkinElmer公司;Cary 100型紫外-可见分光光度仪 美国Varian公司;pH计 梅特勒-托利多仪器有限公司;傅里叶红外光谱仪 美国尼高利仪器公司;SPX-150B型生化培养箱 上海琅玕实验设备有限公司;EYELA N1001型旋转蒸发仪日本东京理化株式会社;ALPHA2-4型冻干机 德国Christ公司;HH-6型数显恒温水浴锅 江苏省金坛市富华仪器有限公司。
1.3 方法
1.3.1 肉桂原花青素的提取工艺
肉桂→粉碎→热水浸提→抽滤→滤液浓缩→醇沉→离心分离→上清液→浓缩除醇→冻干即得CPAs
操作要点:以3g肉桂为原料,经粉碎后,以水为溶剂,用醋酸盐缓冲液调pH值,加热提取,经过滤、滤液浓缩、3倍体积乙醇过夜沉淀、离心分离、减压浓缩、冻干等步骤得到粗原花青素。
1.3.2 原花青素含量检测
采用香草醛-浓盐酸[10]法,以儿茶素为标准品制作标准曲线,得回归方程:y=0.0035x-0.0359,R2=0.9995,其中y为吸光度,x为(+)-儿茶素质量浓度/(μg/mL),线性质量浓度范围为50~250μg/mL。取肉桂提取冻干样,溶解稀释到一定体积V/mL,按标准曲线法测定其吸光度,根据回归方程计算原花青素含量C/(μg/mL)。按下式计算原花青素得率:
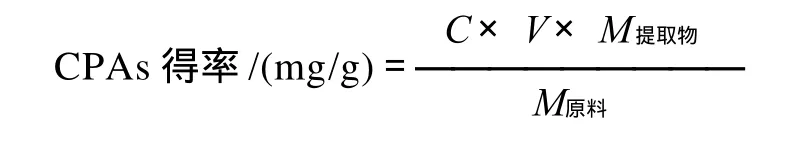
式中:M提取物为肉桂提取冻干样质量/mg;M原料为肉桂原料质量/g。
1.3.3 单因素与正交试验
选择提取温度、液料比、提取时间、pH值等单因素进行试验,在单因素经验基础上,选择液料比、提取温度和提取时间为考察因素,每个因素拟定3个水平,选用L9(33)正交试验表,以原花青素得率作为考核指标,进行正交试验筛选最佳水提工艺条件,因素水平见表1。

表1 肉桂原花青素的提取正交试验因素水平表Table 1 Factors and levels of orthogonal tests
1.3.4 大孔树脂静态吸附与解吸
称取经预处理的干树脂2g于100mL具塞三角瓶中,加入肉桂水提稀释液70mL,室温振荡(100r/min)5h,至吸附平衡,过滤,取上清液测定原花青素含量,计算吸附率。静态吸附完毕,抽滤后用纯净水洗淋。把树脂转移至三角瓶中,加入20mL 70%乙醇溶液,室温100r/min振荡5h,取上清液,测定原花青素含量,计算解吸率。
1.3.5 体外蛋白非酶糖化抑制测定[11]
在pH7.4 PBS缓冲液中加入葡萄糖、BSA、NaN3,使其终质量浓度分别为500mmol/L、50mg/mL和0.2g/L,完全溶解后分装入具塞试管中(每管5mL);加入待测样品(0.1mg/mL),氨基胍为阳性对照组,同时设不加试样的空白对照。
各组反应液置37℃避光密封孵育,7d及30d后,用荧光分光光度仪对空白对照组进行激发波长与发射波长的预扫描,所得最大吸收值时对应波长即为最佳测试条件。在该条件下检测各组的荧光强度值F。计算肉桂原花青素对AGEs形成的抑制率:
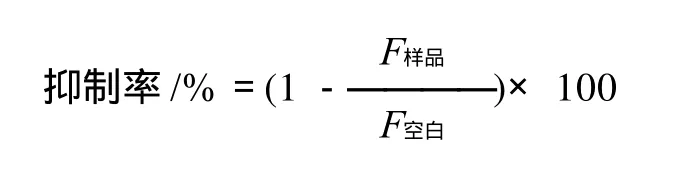
2 结果与分析
2.1 肉桂原花青素提取工艺单因素试验
2.1.1 浸提温度对原花青素得率的影响
在为液料比10:1、浸提时间1.5h、pH6.0条件下,不同提取温度对肉桂原花青素得率的影响见图1。由图1可知,随着浸提温度的升高,肉桂原花青素得率呈上升趋势,当浸提温度达到60℃后上升变化较为缓慢,从节约能源和提高得率的角度考虑,确定浸提温度以60℃为宜。
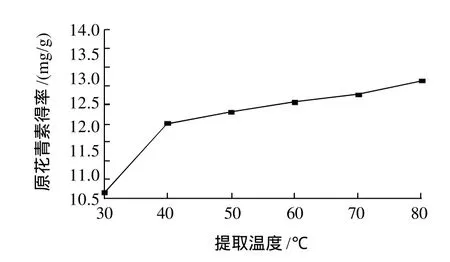
图1 浸提温度对原花青素得率的影响Fig.1 Effect of extraction temperature on extraction rate of CPAs
2.1.2 液料比对原花青素提取率的影响
在浸提温度60℃、浸提时间1.5h、pH6.0的条件下,不同液料比对肉桂原花青素得率的影响见图2。由图2可知,肉桂原花青素得率随着溶剂量的增加而增加,当液料比达到14:1后上升变化较为缓慢,所以确定浸提的液料比以14:1为宜。
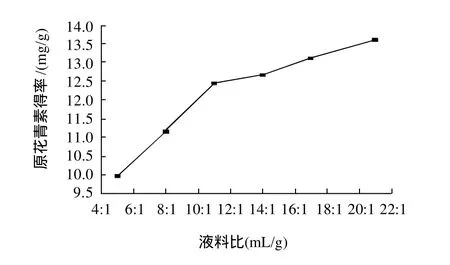
图2 液料比对原花青素得率的影响Fig.2 Effect of liquid/solid ratio on extraction rate of CPAs
2.1.3 浸提时间对原花青素提取率的影响
在浸提温度60℃、液料比14:1、pH6.0条件下,不同浸提时间对肉桂原花青素得率的影响见图3。由图3可知,浸提2.5h左右效果最好,时间过长,对肉桂原花青素提取效果反而不好,所以浸提时间选择2.5h为宜。
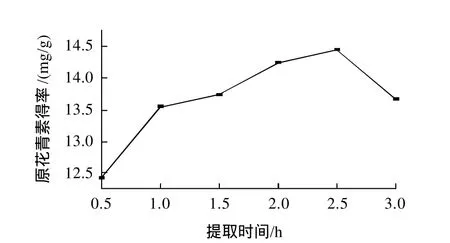
图3 浸提时间对原花青素得率的影响Fig.3 Effect of extraction time on extraction rate of CPAs
2.1.4 浸提液pH值对原花青素提取率的影响
在浸提温度60℃、液料比14:1、浸提时间2h条件下,不同提pH值浸提对肉桂原花青素得率的影响见图4。由图4可知,随着pH值的升高,肉桂原花青素得率呈下降趋势,当pH值达到6后下降明显,确定浸提pH值以5为宜。
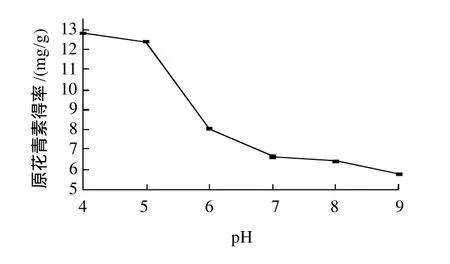
图4 浸提液pH值对原花青素得率的影响Fig.4 Effect of pH on extraction rate of CPAs
2.2 正交试验
分析结果表明,3种考察因素对CPAs提取率影响的大小顺序为B>C>A,即液料比>浸提时间>浸提温度。液料比太小,提取不完全;提取时间太长,得率下降;原花青素在高温下具有热不稳定性,易聚合形成高聚体的鞣质。所以其适宜提取工艺条件:浸提温度60℃、液料比14:1、浸提时间2h、pH5.0,此工艺条件下原花青素得率为14.27mg/g。
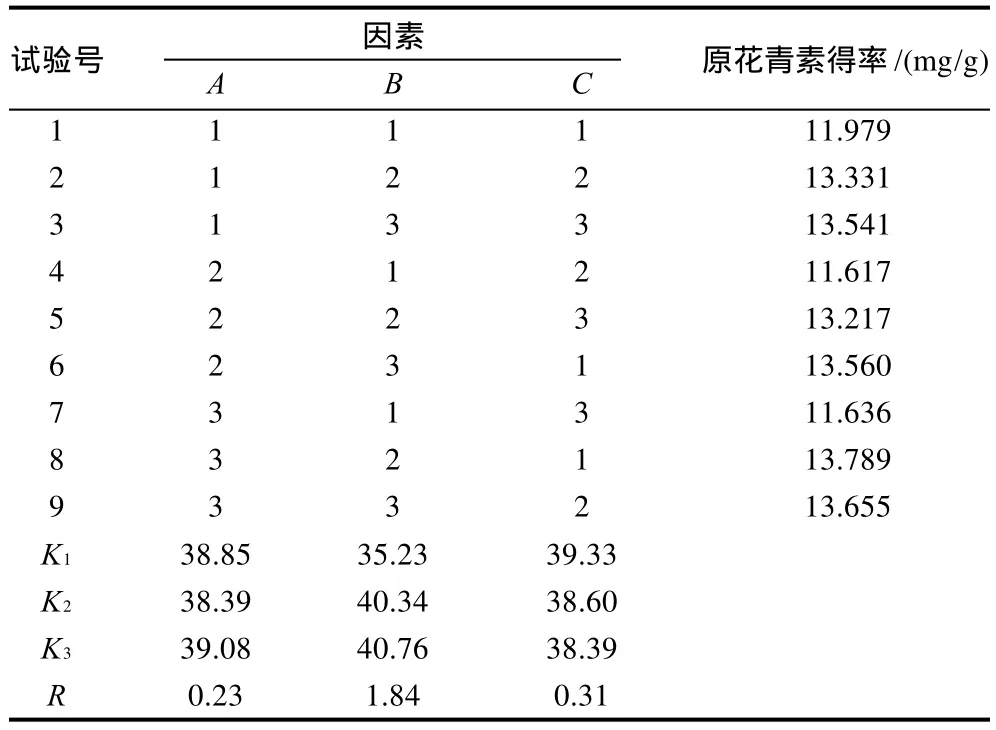
表2 肉桂原花青素提取工艺正交试验结果和极差分析表Table 2 Results of orthogonal tests and range analysis
2.3 大孔树脂纯化试验
通过9种大孔吸附树脂的静态吸附与解吸试验,发现HP-20、D-101、LSA-21树脂对肉桂原花青素的吸附性能较好;ADS-21、LSA-21、LSA-40树脂的解吸性能较好。结合树脂价格综合考虑,确定选用LSA-21树脂对肉桂水提原花青素进行纯化。肉桂水提物经LSA-21树脂纯化后原花青素含量达75%。
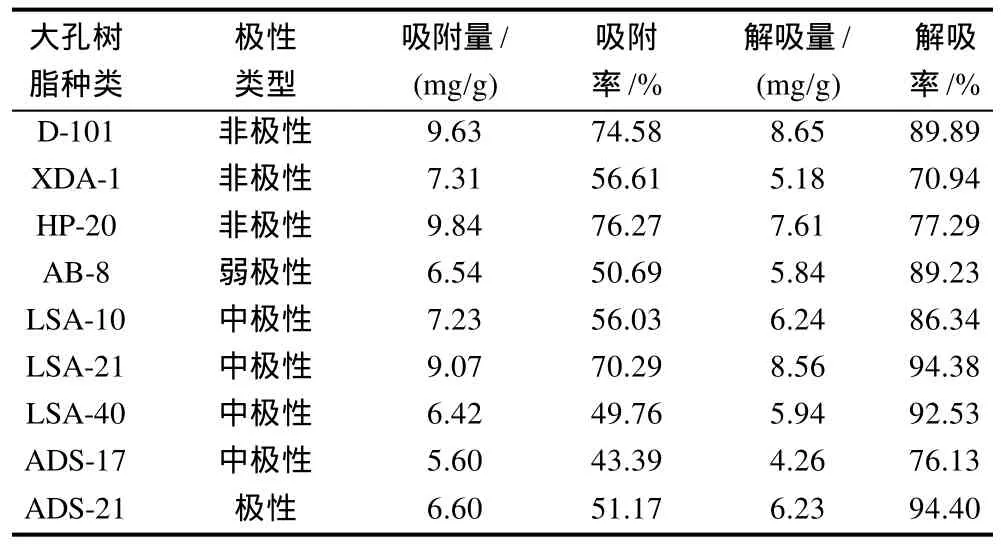
表3 大孔树脂的静态吸附解吸实验结果Table 3 Static adsorption and desorption performance of macro-porous resins
2.4 肉桂原花青素对AGEs形成的影响
2.4.1 AGEs荧光光谱扫描
设定发射波长450 nm,激发波长范围为20 0~440nm,激发狭缝4nm,发射狭缝4nm,扫描步长5nm,扫描速度500nm/min,扫描图见图5。

图5 AGEs的荧光光谱等高线图Fig.5 Fluorescence contour spectra of AGEs
由图5可知,在λEx=380nm,λEm=450nm处有最高荧光峰,因此本实验选择λEx=380nm,λEm=450nm,激发狭缝=4nm,发射狭缝=4nm,发射光滤光片=390nm(Cut-off)作为AGEs测定参数。
2.4.2 肉桂原花青素对AGEs形成的抑制作用
氨基胍是一种亲核肼类小分子化合物,是目前比较公认的AGEs形成抑制剂。作用机制主要是氨基胍能捕获非酶糖化中间产物如甲基乙二醛(MGO)、乙二醛(GO)和3-脱氧葡糖糖醛酮(3-DG)等反应性羰基化合物,形成无生物毒性的加合物,从而抑制AGEs形成。但由于其在美国和加拿大等国进行Ⅲ期临床试验中表现出显着副作用[4],而最终没得以商业化生产与应用。由不同浓度CPAs在孵育第30天时对AGEs形成的抑制率计算得其IC50为45.93μg/mL,高于阳性对照氨基胍的92.30μg/mL。同时对比图6可知,CPAs在非酶糖化反应孵育7d(AGEs形成的早期)就显示出显着抑制作用,而同时期氨基胍抑制效果较差,表明CPAs的抑制机制有别于氨基胍。关于原花青素抑制糖基化反应的作用机理,经初步分析认为原花青素为多酚物质,具有较强抗氧化活性,能清除还原性羰基化合物,同时原花青素属缩合单宁,它能在非酶糖化反应前与相关蛋白结合从而阻止AGEs的形成。
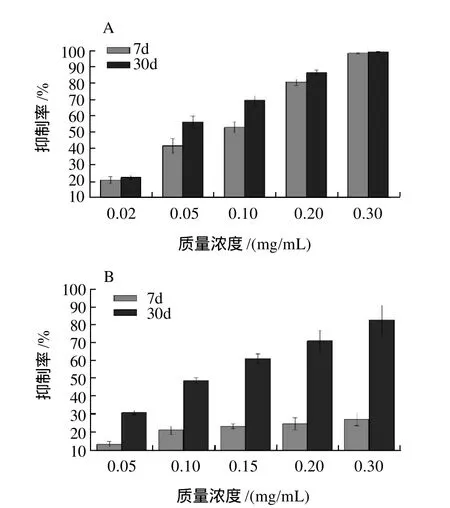
图6 肉桂原花青素(A)和氨基胍(B)对AGEs形成的抑制作用Fig.6 Inhibitory effects of CPAs and aminoguanidimine (positive control) on AGEs formation
2.5 肉桂原花青素的定性鉴定
原花青素本身无色,在热酸条件下降解、氧化可产生深红色花色素离子,反应后溶液为深红色,则表明发生了花色素反应,其产物在546nm处有强吸收。本实验取大孔树脂纯化后的冻干粉末经正丁醇-盐酸分析呈现阳性反应,表明粉末中有原花青素存在。肉桂提取物冻干粉经紫外可见及红外光谱扫描,结果见图7、8。
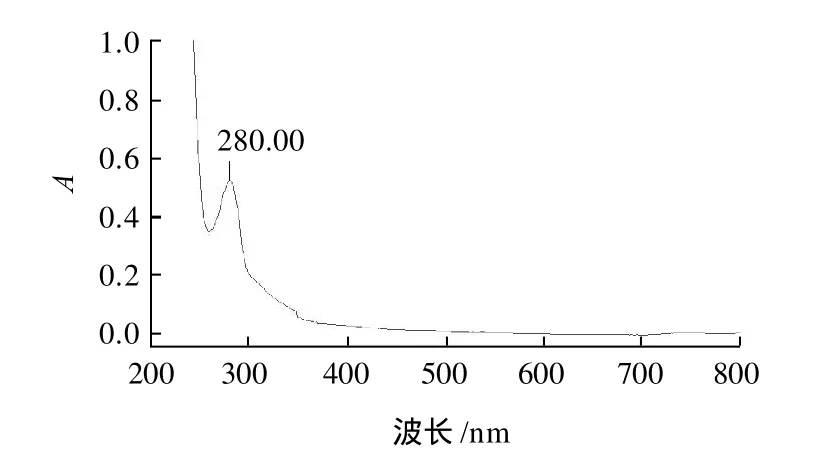
图7 CPAs 的紫外-可见光谱图Fig.7 UV-visible spectrum of CPAs
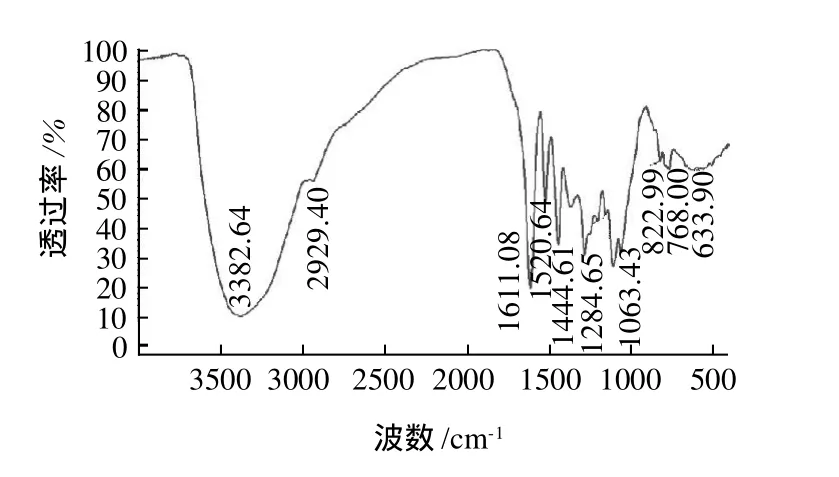
图8 CPAs 的红外光谱图Fig.8 IR spectrum of CPAs
紫外可见扫描表明CPAs在280nm处有唯一吸收峰,红外扫描图谱表明含多羟基及苯环,与原花青素结构特征相符。
3 结 论
肉桂在浸提温度60℃、液料比14:1、浸提时间2h、pH5.0条件下水提,原花青素得率为14.27mg/g。LSA-21树脂对肉桂原花青素具有较好的吸附与解吸性能,经其纯化后原花青素含量可达75%。
肉桂原花青素对体外蛋白非酶糖化具有显着抑制作用,其IC50为45.93μg/mL,高于阳性对照氨基胍,且有别于氨基胍能对非酶糖化早期反应进行抑制。提示肉桂对于糖尿病并发症也具有潜在的防治作用。
[1] GU Liwei, KELM M A, HAMMERSTONE J F, et al. Concentrations of proanthocyanidins in common foods and estimations of normal consumption[J]. J Nutr, 2004, 134(3): 613-617.
[2] 崔介君, 孙培龙, 马新. 原花青素的研究进展[J]. 食品科技, 2003, 28(2): 92-95.
[3] 方琴. 肉桂的研究进展[J]. 中药新药与临床药理, 2007(3): 249-252.
[4] SINGH R, BARDEN A, MORI T, et al. Advanced glycation endproducts: a review[J]. Diabetologia, 2001, 44(2): 129-146.
[5] AHMED N. Advanced glycation endproducts: role in pathology of diabetic complications[J]. Diabetes Res Clin Pract, 2005, 67(1): 3-21.
[6] BROWNLEE M. Lilly lecture 1993: glycation and diabetic complications[J]. Diabetes, 1994, 43(6): 836-841.
[7] KUME S, TAKEYA M, MORI T, et al. Immunohistochemical and ultrastructural detection of advanced glycation end products in atherosclerotic lesions of human aorta with a novel specific monoclonal antibody[J]. Am J Pathol, 1995, 147(3): 654-667.
[8] VITEK M P, BHATTACHARYA K, GLENDENING J M, et al. Advanced glycation end products contribute to amyloidosis in Alzheimer disease[J]. Proc Natl Acad Sci U S A, 1994, 91(11): 4766-4770.
[9] MUNCH G, THOME J, FOLEY P, et al. Advanced glycation endproducts in ageing and Alzheimer's disease[J]. Brain Res Brain Res Rev, 1997, 23(1/2): 134-143.
[10] PRICE M L, SCOYOC S V, BUTER L G. A critical evaluation of the vanillin reaction as an assay for tannin in sorghum grain[J]. J Agric Food Chem, 1978, 26(5): 1214-1218.
[11] BROWNLEE M, VLASSARA H, CERAMI A. Nonenzymatic glycosylation products on collagen covalently trap low-density lipoprotein[J]. Diabetes, 1985, 34(9): 938-941.
Water Extraction of Cinnamon Proanthocyanidins and Its Inhibitory Effect on the Formation of Advanced Glycation End Products
LI Chao,MAO Chao-lun,YONG Ke-lan*
(School of Life Science, Shanghai University, Shanghai 200444, China)
One factor-at-a-time and orthogonal array design methods were used to determine the optimal operating conditions for water extraction of proanthocyanidins from cinnamon (CPAs). Nine types of macroporous adsorption resin were compared for their effectiveness in adsorbing and desorbing CPAs. Meanwhile, the in vitro inhibitory effect of CPAs on the formation of advanced glycation end products (AGEs) was tested. The optimal extraction conditions were found to be 2 h of extraction at 60 ℃with acidic water at pH 5.0 (adjusted with sodium acetate-acetic acid buffe) at a liquid/solid ratio of 14:1 (mL/g). Under these conditions, the extraction rate of CPAs was 14.27 mg/g. LSA-21 resin was the most effective in purifying CPAs. CPAs had strong inhibitory activity on the formation of AGEs with an IC50 of 45.93μg/mL, which was higher than that of the positive control aminoguanidimine.
cinnamon;proanthocyanidins;macroporous resin;advanced glycation end products
TS201.1
A
1002-6630(2012)08-0126-05
2011-03-25
黎超(1986—),男,硕士研究生,研究方向为天然产物化学。E-mail:jackylc@shu.edu.cn
*通信作者:雍克岚(1947—),女,教授,研究方向为天然产物开发利用。E-mail:klyong@staff.shu.edu.cn



