易松强,郑火青,张翠平,魏文挺,胡福良*
蜂蜜中β-葡萄糖苷酶活性测定及其来源分析
易松强,郑火青,张翠平,魏文挺,胡福良*
(浙江大学动物科学学院,浙江 杭州 310029)
以对硝基苯基β-D-葡萄糖苷(pNPG)为底物,对蜂蜜中β-葡萄糖苷酶活性测定条件进行研究。结果表明:蜂蜜中β-葡萄糖苷酶活性测定的最佳条件为以柠檬酸-磷酸氢二钠缓冲液为提取液,pH5.0,温度60℃,底物浓度30mmol/L。酶促反应在2.5h和37℃时酶促反应曲线线性关系最好。研究还发现,β-葡萄糖苷酶可能是蜜蜂在采集加工过程中加入进去的,同时,该酶活性还可能与蜂蜜的新鲜度相关。
蜂蜜;β-葡萄糖苷酶;酶活性;来源
蜂蜜是蜜蜂采集植物的花蜜或分泌物,经过充分酿造而贮藏在巢脾内的甜味物质[1]。蜂蜜中含有丰富的生物酶,如淀粉酶、蔗糖转化酶、葡萄糖氧化酶、过氧化酶、磷酸酶等[2]。酶对热稳定性不强,若对蜂蜜长期贮存或进行加工处理,酶的活性会逐步降低。因此,酶值是反应蜂蜜质量的一个重要指标。
β-葡萄糖苷酶(β-glucosidaseEC3.2.1.21)又称β-D-葡萄糖苷水解酶,属于纤维素酶类,别名龙胆二糖酶、纤维二糖酶和苦杏仁苷酶,是一种能催化水解芳基或烃基与糖基原子团之间的糖苷键生成葡萄糖的酶[3],根据其底物特异性类属于烃基β-葡萄糖苷酶、纤维二糖酶或水解烃基-β-糖苷基和寡聚糖的酶类。β-葡萄糖苷酶广泛分布于植物、动物和微生物[4]。
β-葡萄糖苷酶活性的测定主要有以下3种方法[5]:一是Barush和Swiain法,它以水杨苷作底物,酶解产物用4-氨基安替比林作显色剂,使释放出来的水杨醇显色,再用分光光度法比色测定;二是荧光法,利用伞形酮(7-羟基香豆素)与4-甲基伞形酮具强烈荧光的特点,将它们衍生为无荧光的底物,以此测定;三是比色法,以对硝基苯基β-D-葡萄糖苷(pNPG)为底物进行酶解,底物水解后释放出来的对硝基苯酚在波长400~420nm可见光范围内有特征吸收峰,可直接在此波长范围比色测定。
本研究采用比色法测定不同蜂蜜的β-葡萄糖苷酶活性,并对其测定条件进行优化,包括反应底物的浓度、缓冲液pH值、温度、时间等。同时通过比较油菜花花蜜、蜜蜂体内蜜囊中的蜂蜜和不同成熟度油菜花蜜的β-葡萄糖苷酶活性,分析蜂蜜中该酶的来源以及该酶与蜂蜜新鲜度的相关性。
1 材料与方法
1.1 材料与试剂
油菜花花蜜、蜜囊蜜和油菜蜜均于2009年油菜花期采自浙江省平湖市;洋槐蜜和椴树蜜陈蜜于2008年分别采自辽宁和吉林,由杭州健蜂蜂业有限公司提供。
对硝基苯酚(化学纯);对-硝基苯-β-D-葡萄糖苷Chemsynlab公司;其他试剂均为分析纯;所用水均为蒸馏水。
UV2550紫外-可见分光光度计 日本岛津公司;电子分析天平 北京赛多利斯仪器系统有限公司;DK-8D型电热恒温水槽 上海精宏实验设备有限公司。
1.2 方法
1.2.1 油菜花花蜜
在油菜花盛开期,随机选定几片油菜田作为实验区,同时选含苞待放花朵较多的花枝进行套袋处理。在次日上午9:30~11:30用毛细吸管吸取花朵中的花蜜,置于冰浴的0.5mL离心管中,达到一定量后将其密封并贮存于-18℃冰箱中。共收集油菜花花蜜6小管,每小管约0.4mL(约0.5g),共约2.4mL。每小管用2mL柠檬酸-磷酸氢二钠缓冲液进行稀释,检测β-葡萄糖苷酶活性。1.2.2蜜囊蜜
在蜂箱巢门口,用镊子夹住一定数量的返巢采集蜂并装入样品袋,然后用镊子将蜜蜂的蜜囊取出,并把蜜囊扯破让蜜囊中的蜜滴到1.5mL的离心管中,达到一定量后将其密封并放入-18℃冰箱里贮存。共收集蜜囊蜜6小管,每小管1.0mL(约1.4g),共6.0mL。样品冷冻于-18℃备用。每小管取1.0g用5mL柠檬酸-磷酸氢二钠缓冲液进行稀释,检测β-葡萄糖苷酶活性。
1.2.3 油菜蜜
在油菜花期间,当日早晨,先将随机选定的6个实验强群继箱中的蜜脾全部摇空,傍晚摇出蜂蜜并分装到50mL的离心管中,分装完毕立即置于-18℃冰箱内贮存。以相同方法分别在摇空蜜脾3d和6d后生产更高浓度的油菜蜜。经测定,3种油菜蜜的浓度分别为37、39、41°Be。样品冷冻于-18℃备用。
1.2.4 白糖蜂蜜
在外界蜜粉源严重缺乏的季节,选择6群强群摇空蜜脾后,早、中、晚各一次饲喂浓糖水,连续饲喂2d,2d后摇出蜂蜜(白糖蜂蜜)。各群蜂蜜样品分装后冷冻于-18℃备用。
1.2.5 粗酶液配制
准确称取1.00g蜂蜜于25mL烧杯中,用少量柠檬酸-磷酸氢二钠缓冲液溶解,然后转移到10mL容量瓶中,并用上述缓冲液定容。
1.2.6 酶活力的定义
酶活力单位是每分钟催化形成1μmoL对硝基苯酚所需要的酶量为一个酶活力单位。蜂蜜中β-葡萄糖苷酶活力为每克蜂蜜具有的酶活力单位数。
1.2.7 β-葡萄糖苷酶活性的测定
取0.5mL粗酶液,加入0.5mL不同浓度对硝基苯基β-D-葡萄糖苷(pNPG)。将此反应混合液在不同温度的水浴锅内水浴不同时间,待反应结束后,立即加入2.5mL 1mol/L Na2CO3终止液终止反应,冷却至室温后在400nm波长处测定吸光度[6]。另外,取相同条件的反应液立即置于沸水浴中加热5min灭活后加入2.5mL 1mol/L Na2CO3溶液,作为空白对照。
1.2.8 pH值和底物浓度对酶活性的影响
配制不同pH值(pH 4、5、6、7)的柠檬酸-磷酸氢二钠缓冲液(pH 4、5、6、7),在37℃,底物(pNPG)浓度为10mmol/L,反应1.5 h后,在400nm波长处测定其吸光度。配制不同的底物浓度(10、20、30、40、50mmol/L),以适合pH值的磷酸盐缓冲液作为提取液,在37℃水浴中加热1.5h后,在400nm波长处检测其吸光度。每组数据3个重复,以平均数计。
1.2.9 温度和反应时间对酶活性的影响
设pH5.0,反应时间为1.5h,分别测定30、40、50、60、70、80℃时400nm波长处的吸光度,检测得出该酶最适反应温度。设pH5.0,反应温度为30、37、45、50℃且各温度下反应时间为0、0.5、1、1.5、2、2.5h,检测酶促反应曲线。每组数据3个重复,取平均值。
2 结果与分析
2.1 缓冲液pH值对酶活性的影响
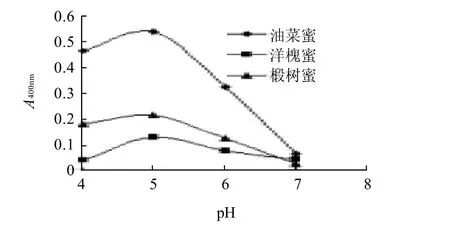
图1 缓冲液pH值对酶活性的影响Fig.1 Effect of buffer pH on β-glucosodase activity
由图1可知,3种蜂蜜都在pH 5.0时吸光度达到最大值,可知测定蜂蜜中β-葡萄糖苷酶活性所用缓冲液以pH 5.0为最佳。
2.2 温度和反应时间对酶活性的影响
如图2所示,随着反应温度的上升,酶活力显着增加。但当温度继续升高到60℃时,其酶活力逐步降低,表明该酶的最适温度是60℃。
按1.2.9节方法,测400nm波长处吸光度,由图3可见,线性回归方程分别为y = 0.1946x + 0.0373,R2= 0.9746;y = 0.3466x-0.0144,R2= 0.9986;y = 0.3886x + 0.0527,R2= 0.9891;y = 0.4739x + 0.0768,R2= 0.98。从以上数据可知,酶促反应在2.5h内的线性关系中37℃最好,其他相对次之。所以,蜂蜜中β-葡萄糖苷酶酶活性分析条件以37℃最适。
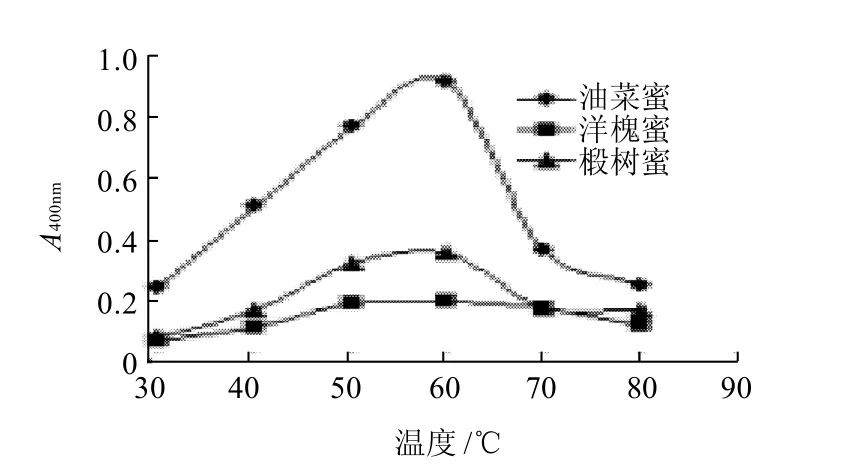
图2 反应温度对酶活性的影响Fig.2 Effect of reaction temperature on β-glucosidase activity
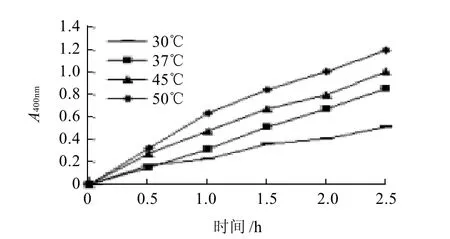
图3 不同温度、时间的酶促反应曲线Fig.3 β-glucosidase reaction curves at different temperatures
2.3 不同底物浓度对酶活性的影响
底物浓度是决定酶反应速率的一关键因素。在低底物浓度时,反应速率与底物浓度成正比;当底物浓度增大时,随着底物浓度增加,反应速率亦虽随之增加,但不会与底物浓度成正比;当底物浓度增加到一定程度后,反应速率不受底物浓度的影响而趋于恒定,这时表明已达到测定酶活性时底物过量的要求。底物浓度对酶活性的影响见图4。

图4 不同底物浓度对酶活性的影响Fig.4 Substrate concentration dependence of β-glucosidase activity
由4图可知,当底物浓度在0~30mmol/L时,随底物浓度的升高,其产物生成速率也加快;但当底物浓度进一步增加时,产物生成速率不断减小随之趋于恒定。因此,测定蜂蜜中β-葡萄糖苷酶酶活性时,其底物浓度应大于30mmol/L。
综上可知,蜂蜜中β-葡萄糖苷酶活性测定的最佳条件是:柠檬酸-磷酸氢二钠缓冲液pH5.0,反应温度为37℃,最适反应温度为60℃,底物浓度大于30mmol/L,反应时间在2.5h内。
2.4 蜂蜜中β-葡萄糖苷酶的来源
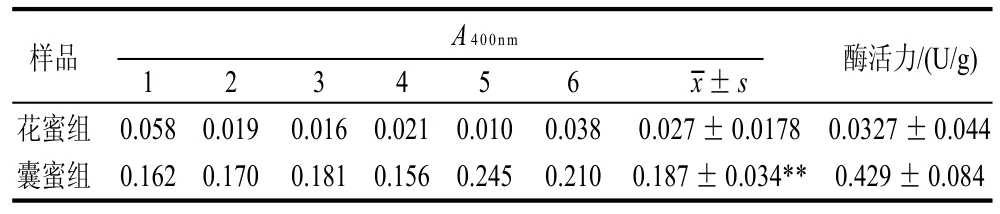
表1 油菜花花蜜和蜜囊蜜中的β-葡萄糖苷酶活力Table 1 β-glucosidase activity of rape honey and honey from bee bag
由表1可知,油菜花花蜜中的β-葡萄糖苷酶活性很低,而蜜囊蜜中的β-葡萄糖苷酶活性相对较高。t检验分析结果表明,蜜囊蜜中的β-葡萄糖苷酶活性显着高于油菜花花蜜中该酶的活性。油菜花花蜜中酶活A400nm值均小于0.100,而仪器测量的准确度为0.100~0.900,所以测量结果误差大、精确度偏低。
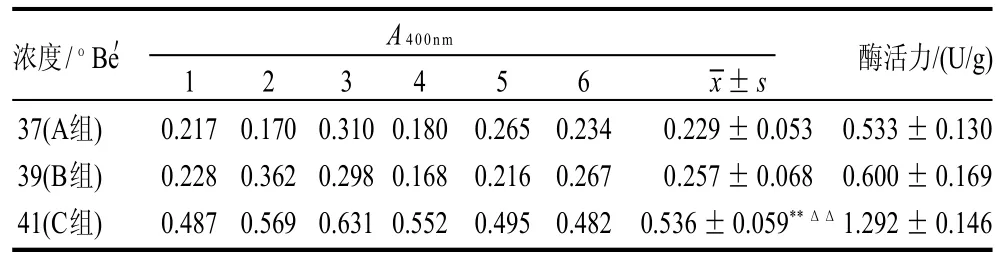
表2 不同浓度梯度油菜蜜的酶活力Table 2 β-glucosidase activity of different concentrations of rape honey
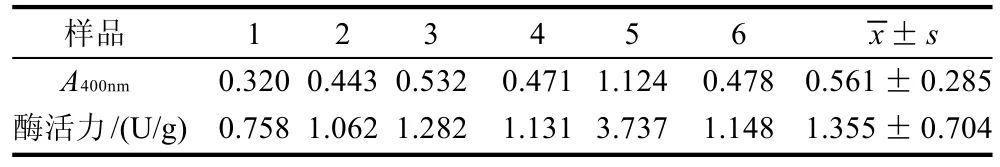
表3 饲喂白糖水蜂群所产蜂蜜的酶活力Table 3 β-glucosidase activity of honey produced by bee population fed white sugar
由表3可看出,喂以白糖水的蜂蜜均检测出β-葡萄糖苷酶活性,且样本5的酶活特别高。而在表2中,不同浓度油菜蜜间的β-葡萄糖苷酶活性存在一定的差异。两两t检验分析结果表明,C组酶活力对A组和B组均差异极显着,而B组酶活力对A组差异不显着。
3 讨 论
在酶的提取过程中,缓冲液的种类及pH值对提取效果影响非常大。宋晓青等[7]在蜡梅β-葡萄糖苷酶的活性分析、分离纯化与性质的研究中,发现当缓冲液pH值为5.0时,各种缓冲液处理的酶活力均达到最高,且柠檬酸-柠檬酸三钠处理的酶活力高于其他缓冲液。李华等[8]分别用不同缓冲液提取葡萄浆果中β-葡萄糖苷酶时,发现柠檬酸-磷酸氢二钠缓冲液pH6.0时提取效果最好。这表明,β-葡萄糖苷酶的来源不同,其酶性质也存在差异,并且各研究中其酶的优化条件不同,也使优化结果不一致。本实验用柠檬酸-磷酸氢二钠提取蜂蜜中的β-葡萄糖苷酶,对其pH值进行优化。结果表明,最适pH值在5.0左右,比Low等[6]报道的蜂蜜中β-葡萄糖苷酶的最佳pH值为4.2略高,但与Pontoh等[9]研究的从Apis mellifera胃和蜜囊中分离纯化到的β-葡萄糖苷酶的最优pH值为5.0相一致。
在其他植物以pNPG为底物检测β-葡萄糖苷酶活性的研究中,对该酶的优化结果大致是最适pH值为4.5~6.5,最适温度30~60℃。从大麦[10]分离纯化得到的β-葡萄糖苷酶的最适pH值为5.0,这与Sue等[11]研究的结果相一致。但这比香菇(pH4.0)[12]、稻谷(pH 4.5)[13]、大豆(pH4.5)[14]略高,而比柑橘(pH5.5)[15]、玉米(pH5.8)[16]和香子兰(pH 6.5)[17]要低。从大麦[12]、香菇[13]中分离纯化得到的β-葡萄糖苷酶的最适温度为60℃,这与本研究结果一致。但这比大豆(45℃)[14]、香子兰(40℃)[17]高。该酶酶促反应曲线的最佳温度是37℃,这与宋晓青[7]报道的结果相一致。
β-葡萄糖苷酶在植物、动物、真菌和细菌中都有广泛分布,已报道的β-葡萄糖苷酶的最适pH值大多数在酸性范围,并且变化不是很大。其最适温度在40~110℃之间都有分布:一般来说,来自植物的β-葡萄糖苷酶最适温度在40℃左右,而来自古细菌的β-葡萄糖苷酶其热稳定性和最适温度要高于普通微生物或动物来源的β-葡萄糖苷酶[18]。如古细菌Pyrococcus furiosus的β-葡萄糖苷酶其最适温度为102~105℃[19]。这也说明不同来源的β-葡萄糖苷酶,其性质存在一定差异。
从本实验研究结果可推测,蜂蜜中的β-葡萄糖苷酶主要来源于蜜蜂,也就是说蜜蜂在采集加工的过程中添加了这种酶。这与Pontoh等[9]在研究中暗示,β-葡萄糖苷酶可能由蜜蜂的咽下腺产生并分泌到口器而传递到外界相吻合。在对蜂群喂以浓白糖水的实验中,也可以初步确定蜂蜜β-葡萄糖苷酶极有可能是蜜蜂在采集加工过程中添加到蜂蜜中的。而在油菜花花蜜中检测β-葡萄糖苷酶,发现其活性非常低,这可能是因为人为采集花蜜的过程中混入了一些花粉或其他微生物。但是至于蜜蜂为什幺要添加β-葡萄糖苷酶到蜂蜜中,仍然还不清楚。
β-葡萄糖苷酶作为蜂蜜中的一种酶,可能与淀粉酶、转化酶等有相似的性质,彼此间存在相互关联,即通过检测其中一种酶活性时就可以预测另一种酶活性高低[20]。也可能在加工贮藏过程中存在相同的变化趋势,其酶活力都会有一个下降的过程。但β-葡萄糖苷酶能否作为评价蜂蜜新鲜度的一个指标,有待进一步的研究。
[1]曾志将. 养蜂学[M]. 北京: 中国农业出版社, 2003.
[2]陈盛禄. 中国蜜蜂学[M]. 北京: 中国农业出版社, 2001.
[3]International Union of Biochemistry. Enzyme nomenclature: recommendations of the Nomenclature Committee of the International Union of Biochemistry and Molecular Biology on the nomenclature and classification of enzymes[M]. San Diego: Academic Press, 1992: 310.
[4]ROBINSON J.The oxford companion to wine[M]. United States: Oxford University Press lnc, 1999: 95.
[5]王华夫, 游小青. 茶叶中β-葡萄糖苷酶活性的测定[J]. 中国茶叶, 1996(3): 16-17.
[6]LOW N H, VONG K V, SPORNS P. A new enzyme, β-glucosidase, in honey[J]. Journal of Apicultural Research, 1986, 25: 178-181.
[7]宋晓青. 腊梅花β-葡萄糖苷酶的活性分析、分离纯化与性质的初步研究[D]. 武汉: 华中农业大学, 2005.
[8]李华, 高丽. 葡萄浆果中β-葡萄糖苷酶活性测定条件的研究[J]. 酿酒科技, 2007(8): 146-149.
[9]PONTOH J, LOW N H. Purification and characterization of β-glucosidase from honey bees (Apis mellifera)[J]. Insect Biochemistry and Molecular Biology, 2002, 32: 679-690.
[10]LEAH R, KIGEL J, SVENDSEN I, et al. Biochemical and molecular characterization of a barley seed beta-glucosidase[J]. Journal Biological Chemistry, 1995, 270: 15789-15797.
[11]SUE M, IWAMURA H. Purification and characterization of a hydroxamic acid glucoside β-glucosidase from wheat (Triticum aestivum L.) seedlings [J]. Planta, 2000, 210: 432-438.
[12]孙艳梅, 张永忠, 徐雅琴, 等. 香菇中部分纯化β-葡萄糖苷酶的酶学性质[J]. 食品工业科技, 2007(12): 63-68.
[13]AKIYAMA T, KAKU H, SHIBUYA N. A cell wall-bound beta-glucosidase from germinated rice: Purification and properties[J]. Phytochemistry, 1998, 48: 49-54.
[14]MASARU M, SASAKI J, MURAO S. Studies on β-glucosidase from soybeans that hydrolyze daizin and genistin: Isolation and characterization of an isozyme[J]. Biosci Biotech Biochem, 1995, 59: 1623-1627.
[15]CAMERON R G, MANTHEY J A, BAKER P A, et al. Purification and characterization of a beta-glucosidase from Citrus sinensis var. Valencia fruit tissue[J]. Journal of Agricultural and Food Chemistry, 2001, 49: 4457-4462.
[16]CUEVAS L, NIEMEYER H M, JONSSON L M V. Partial purification and partial characterization of β-D-glucosidase from maize[J]. Phytochemistry, 1992, 31: 2069-2612.
[17]ODOUX E, CHAUWIN A, BRILLOUET J M. Purification and characterization of vanilla bean (Vantilla planifolia Andrews) β-D-glucosidase [J]. Journal of Agricultural and Food Chemistry, 2003, 51: 3168-3173.
[18]王志江, 魏红福. β-葡萄糖苷酶的研究[J]. 饲料工业, 2006, 27(22): 20-22.
[19]彭喜春, 彭志英. β-葡萄糖苷酶的研究现状及应用前景[J]. 江苏食品与发酵, 2001(4): 22-25.
[20]HUIDOBRO J F, SANTANA F J, SANCHEZ M P, et al. Diastase, invertase and β-glucosidase activities in fresh honey from northwest Spain[J]. Journal of Apicultural Research, 1995, 34(1): 39-44.
Determination ofβ-Glucosidase Activity and Source in Honey
YI Song-qiang,ZHENG Huo-qing,ZHANG Cui-ping,WEI Wen-ting,HU Fu-liang*
(College of Animal Sciences, Zhejiang University, Hangzhou 310029, China)
The determination conditions of β-glucosidase activity in honey were investigated by using p-Nitrophany β-DGluopyranoside (pNPG) as substrate. The optimal reaction pH and temperature of β-glucosidase were 5.0 and 60 ℃, respectively. The enzymatic reaction curve at 37 ℃ and a substrate concentration of 30 mmol/L presented the best linearity. This enzyme may be added into honey during harvest and processing and its activity can be an indicator for the freshness of honey.
honey;β-glucosidase;enzyme activity;source
S896.1
A
1002-6630(2010)19-0241-04
2009-11-21
国家现代农业(蜂)产业技术体系建设专项(NYCYTX-43)
易松强(1987—),男,硕士研究生,研究方向为蜜蜂科学。E-mail:yisongqiang87@yahoo.cn
*通信作者:胡福良(1964—),男,教授,博士,研究方向为蜜蜂科学。E-mail:flhu@zju.edu.cn



