张 银,佟 平,麻小娟,李 欣,陈红兵,*
热加工及超高压处理对卵白蛋白抗原性的影响
张 银1,2,佟 平1,3,麻小娟1,2,李 欣1,3,陈红兵1,3,*
(1.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2.南昌大学生命科学与食品工程学院,江西 南昌330047;3.南昌大学 中德联合研究院,江西 南昌 330047)
以蛋清为原料,采用加热加工、动态超高压加工及两种方法结合处理,研究不同加工方式对蛋清中卵白蛋白抗原性的影响。结果表明:卵白蛋白抗原性随着加热温度的升高而降低,最高降低68%,且抗原性急剧降低的临界温度是80℃;经超高压均质处理后,其抗原性随着压力的升高先降低后回升;经二者结合处理后,卵白蛋白抗原性与单独加热处理变化趋势相似,但无单独热处理变化幅度大,最高降低52.5%;表明了热处理对卵白蛋白抗原性的影响比超高压大,结果为研发低致敏性或无致敏性蛋制品提供参考。
加热;动态超高压微射流;卵白蛋白;鸡蛋过敏
鸡蛋中含有大量的维生素和矿物质及有高生物价值的蛋白质,是人类食物蛋白最好的来源之一。但鸡蛋也是世界粮农组织(FAO)认定的八大食物过敏原之一[1]。近年来鸡蛋过敏疾病的发生率呈上升趋势,而且以婴幼儿和儿童为主,在此类人群的食物过敏中,鸡蛋过敏就占了35%[2],甚至超过了牛奶过敏[3]。鸡蛋中的过敏原主要包括卵类黏蛋白(Gal d1)、卵白蛋白(Gal d2)、卵转铁蛋白(Gal d3)、溶菌酶(Gal d4)。其中卵白蛋白(ovalbumin,OVA)在鸡蛋中含量最多,占蛋清蛋白的54%,具有很好的营养价值和功能特性,常被用于食品配料中[4]。另外,卵白蛋白分子质量为45kD,等电点是pH4.5。
蛋白质在经不同的物理、化学等加工处理后,它的结构会发生一系列变化,而蛋白结构的改变会对其免疫学性质产生影响。在以往的一些临床研究中[5-7]已有报道,一些鸡蛋过敏人群食用热加工处理后的鸡蛋所产生的阳性过敏反应可降低甚至消除;Hildebrandt等[8]用消毒处理的鸡蛋为原料,通过一系列的加热与酶解处理后发现其过敏原性可降低至1%;Iametti等[9]指出,卵白蛋白经超高压处理后,其抗原性可降低至40%,但关于超高压后再加热以及单纯加热对蛋清中的卵白蛋白过敏原性的影响目前还未见报道。本研究对鸡蛋蛋清分别进行热处理、加压处理及二者先后处理,采用间接ELISA方法对其中的卵白蛋白抗原性进行评估,旨在探索热处理、加压处理对卵白蛋白抗原性的影响,为开展低过敏或无过敏的蛋制品研究提供参考。
1 材料与方法
1.1 材料、试剂与仪器
羊抗兔IgG:HRP酶标二抗、OPD底物 美国Sigma公司;抗卵白蛋白兔多克隆抗体(效价1:25000) 实验室利用常规免疫途径自制;96孔可拆酶标板 深圳金灿华实业有限公司。
Model 860酶联免疫检测仪 美国Bio-Rad公司;M-700型微射流均质机 美国Microfluidics公司;双光束紫外分光光度计 北京普析通用仪器有限责任公司。
1.2 方法
1.2.1 蛋清分离及处理
鸡蛋去壳,取蛋清用水稀释1倍,调pH值至6.0,搅拌3h,于3000×g离心3min,取上清,上清再调pH值至8.0,于2500×g离心30min取上清,-20℃保存备用。
1.2.2 蛋清中蛋白质量浓度测定
采用Lowry法[10]测定。
1.2.3 蛋清加热
将已处理蛋清用磷酸盐缓冲液(pH7.0)稀释至1.5μg/mL,于水浴锅中进行加热,加热温度分别为55、60、70、80、85、90、95、100℃;每个温度分别于5、15、30、45、60min各取出一管,立即放于冰上冷却至室温。
1.2.4 超高压处理
将蛋清用磷酸盐缓冲液(pH7.0)稀释至1.5μg/mL,过微射流均质机处理,均质压力分别为40、60、90、120、150、180MPa,处理后立即做抗原性评估,其余部分-40℃保存。
1.2.5 超高压样品加热处理
选取-40℃储存的40、90、180MPa超高压处理后的蛋清进行加热处理,加热温度为60、70、80、90、100℃。
1.2.6 抗原性评估
采用间接ELISA法对加工后样品进行抗原性评估:将上述处理好的蛋清与未加工蛋清(1.5μg/mL)分别包被96孔酶标板,每个样品包被3孔,其中一孔作为阴性对照,4℃孵育过夜;用5g/100mL脱脂乳37℃封阻1h,TBST洗板后加入1:15000稀释的抗OVA兔血清和阴性血清,37℃孵育1h;再次洗板后加入1:104稀释的HRP酶标羊抗兔IgG二抗,37℃孵育1h;洗板后加OPD底物显色、终止、在490nm波长处比色。每板平行做两次,取平均值。
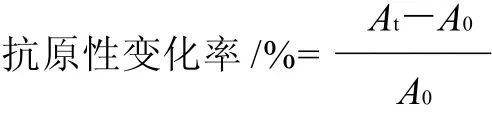
式中:At为在t时刻蛋清中卵白蛋白的吸光度;A0为未加工蛋清中卵白蛋白的吸光度。
2 结果与分析
2.1 蛋清蛋白质量浓度测定
将蛋清进行搅拌离心处理,去除大部分杂蛋白及黏蛋白后,用Lowry法测定蛋清蛋白的质量浓度。以牛血清白蛋白(BSA)标准品作标准溶液,制作标准曲线如图1所示。
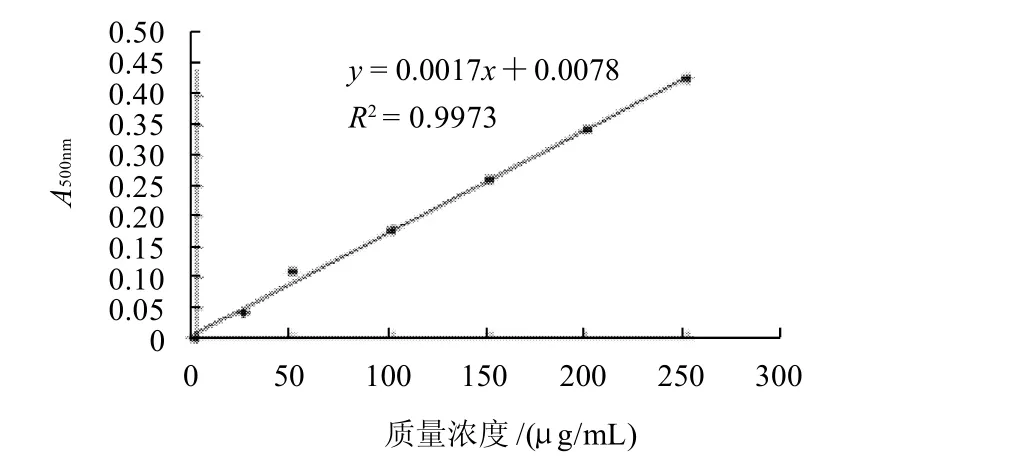
图1 蛋白质质量浓度标准曲线Fig.1 Standard curve for determining protein concentration
由图1可知,BSA在0~250μg/mL质量浓度范围内呈良好线性关系,将蛋清稀释适当倍数后,按1.2.2节测定步骤于500nm波长处测其吸光度,从标准曲线中查知蛋清中蛋白质量浓度为80.76mg/mL。
2.2 加热对卵白蛋白抗原性的影响
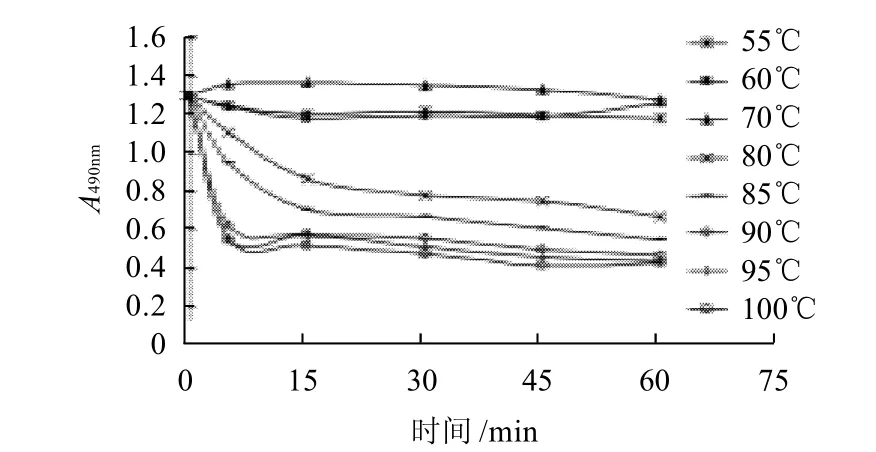
图2 加热温度对卵白蛋白抗原性的影响Fig.2 Change of ovalbumin antigenicity during single heat treatment at various temperatures
由图2、3看出,55℃低温加热时,蛋清中的卵白蛋白抗原性降低,但变化幅度不大,最高仅降低了8.92%,且随着加热时间的延长变化不明显;60℃加热时,卵白蛋白抗原性随着加热时间的延长也略有降低,但加热至60min,其抗原性突然升高,但仍然低于未加热样品;在70℃条件下加热5~45min,卵白蛋白抗原性略有升高,平均比未加热样品高4.2%,而加热60min后抗原性开始降低;当温度升高到80℃时,卵白蛋白抗原性急剧降低;继续加热,温度越高,加热时间越长,抗原性越低,最高可降低68%。但当加热温度超过90℃时,在加热时间范围内抗原性随温度变化不明显,趋于平稳。
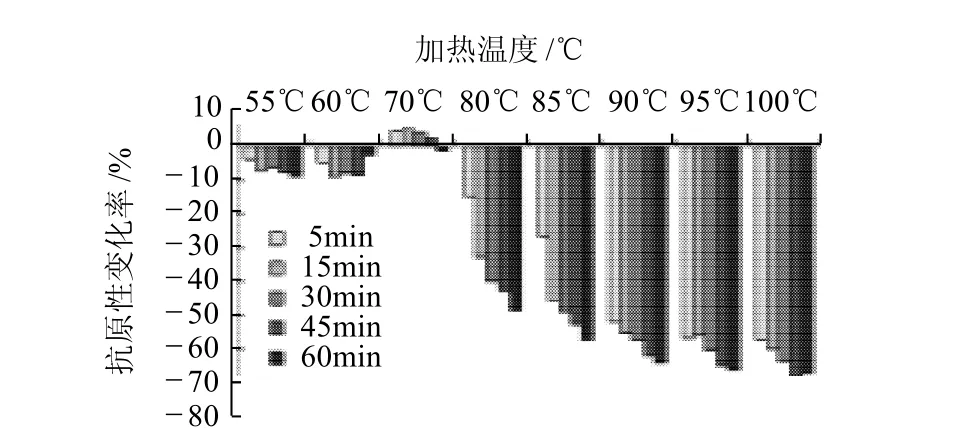
图3 不同加热温度和加热时间对蛋清中卵白蛋白抗原性变化程度的影响Fig.3 Effects of heat temperature and time on the changing extent of ovalbumin antigenicity during single heat treatment
加热可改变蛋白质的抗原性是由蛋白质结构变化引起的,蛋白质加热后在一些共价或非共价作用下形成分子内或分子间聚合物,这种聚合物在一定程度上掩盖了蛋白过敏原表位,进而影响蛋白质免疫反应性[11]。Kato等[12]在早年的研究中表明蛋清热处理会造成卵白蛋白分子结构的改变,使卵白蛋白分子内α-螺旋和β-转角向β-折叠转化,分子间β-折叠结构的交联使分子结构展开,暴露出疏水基团,进而产生聚合物。涂宗财等[13]的研究中也指出在卵白蛋白分子凝集过程中,起主要作用的是分子间β-折叠结构。每分子卵白蛋白中含有1个二硫键和4个巯基[14],在高温处理下,随着β-折叠结构的交联卵白蛋白分子多肽链被打开,充分变性和伸展,暴露出内部疏水性巯基基团,随着温度的增加,巯基发生氧化或与二硫化物交换,形成新生二硫键,使蛋白质分子间发生相互作用,从而产生缔合物[15]。卵白蛋白多肽链的打开与聚合物的生成都会影响卵白蛋白抗原性。
在蛋清加热过程中,加热温度为55、60℃时,卵白蛋白抗原性降低不明显,估计是低温加热使卵白蛋白分子结构展开,暴露出部分疏水基团,掩盖了部分过敏原表位,进而降低其抗原性,但是由于这两个加热温度较低,卵白蛋白结构变化不显着,抗原性降低不明显;而在60℃加热60min,随着加热时间的增长,分子内部隐藏的表位开始暴露出来,使卵白蛋白抗原性略有回升,直至70℃加热5min,在这个过程中,卵白蛋白分子的展开一方面暴露出疏水残基而趋于聚合,一方面掩藏在分子内部的表位暴露出来,大量暴露的表位掩盖了前一种作用而使卵白蛋白抗原性较未加工样品略有升高;随着加热时间的增长,暴露的疏水基团增加,至70℃加热60min后,这两种作用基本相平,卵白蛋白抗原性降低至与未处理样品相似;加热温度超过70℃以上,随着温度的升高,卵白蛋白分子充分伸展,暴露的巯基基团使分子间形成二硫键,促进蛋白质分子间相互作用而产生大量缔合物,使卵白蛋白抗原性大幅度降低。由图可以推测,卵白蛋白分子发生这一变化的临界温度在80℃。
2.3 超高压对卵白蛋白抗原性的影响

图4 超高压对卵白蛋白抗原性的影响Fig.4 Change of ovalbumin antigenicity with pressure during high-pressure microfluidization
由图4可知,蛋清经超高压处理后,卵白蛋白抗原性随着压力的升高程“U”型分布。在40~90MPa压力下,卵白蛋白抗原性随压力的升高而下降;在120MPa下,卵白蛋白抗原性开始略有回升;当压力到180MPa,卵白蛋白抗原性基本与未处理相同。但是可以看出,在实验压力范围内,卵白蛋白抗原性变化幅度较小,最大仅变化了15%左右。
动态超高压微射流均质技术是一种高效的超微细化技术,样品在加工过程中受到高速撞击、瞬间剪切、空穴爆炸等机械力作用,可能导致大分子结构的变化与性质改变[16]。高压处理与热处理对蛋白分子的影响有一定的相似之处,涂宗财等[13]指出:在高压影响下,分子间β-折叠结构的产生导致卵白蛋白分子间交联的增加,促进了二硫键的形成与交换,进而形成密度较大的蛋白质凝胶网络结构,这与前述热处理对卵白蛋白结构的影响相似,蛋白质的凝聚使卵白蛋白抗原性降低。但是高压处理下,卵白蛋白结构产生了多方面的变化。王辉等[17]报道了蛋清蛋白在压力影响下,疏水基团含量随着压力的升高而升高,但超过100MPa后又呈下降趋势,并指出:高压处理一方面使蛋清蛋白的大分子展开,由于蛋白质分子间相互作用增强而导致蛋白分子有相互凝聚的趋势;另一方面,蛋清蛋白质经超高压处理后,大的凝聚体被打破,使得更多可溶性活性聚合体产生,促进蛋白质与水之间的作用力,从而降低蛋白质分子间的相互作用力,阻止蛋白分子的凝聚。推测在40~90MPa压力下,卵白蛋白分子充分展开,疏水基团的暴露使其抗原性降低,而在120~180MPa处理下,卵白蛋白分子一方面在β-折叠结构交联的作用下形成聚合体,一方面由于压力较大,已形成的一些凝聚体又被打破成为可溶性聚合体,使卵白蛋白抗原性有所回升,至180MPa条件下,两种主要作用力基本达到相互平衡,所以其抗原性与未处理样品基本相同。
2.4 超高压样品加热对卵白蛋白抗原性的影响
选取卵白蛋白抗原性差异相对较大的40、90、180MPa超高压样品(-40℃储存)再进行加热处理,用与前面相同的间接ELISA法评估卵白蛋白抗原性,评价二者对卵白蛋白抗原性影响的关系,结果如图5~7所示。
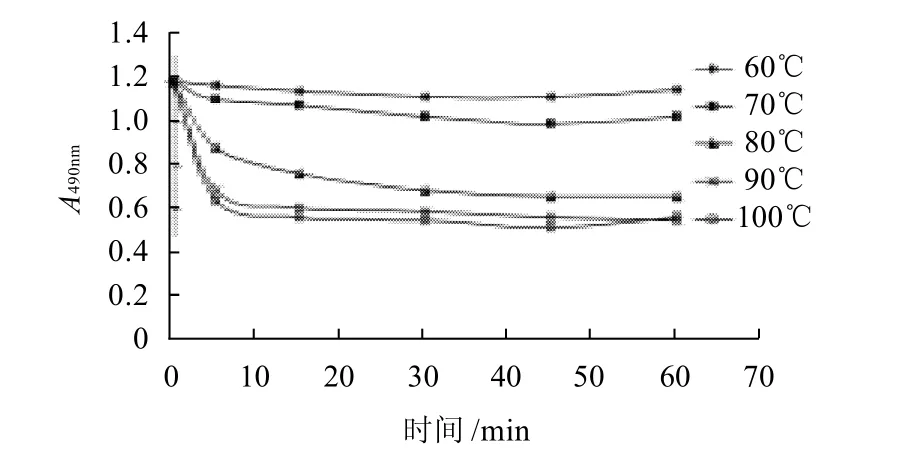
图5 40MPa处理后加热不同温度对卵白蛋白抗原性的影响Fig.5 Antigenicity change of 40 MPa treated ovalbumin during heat treatment at various temperatures
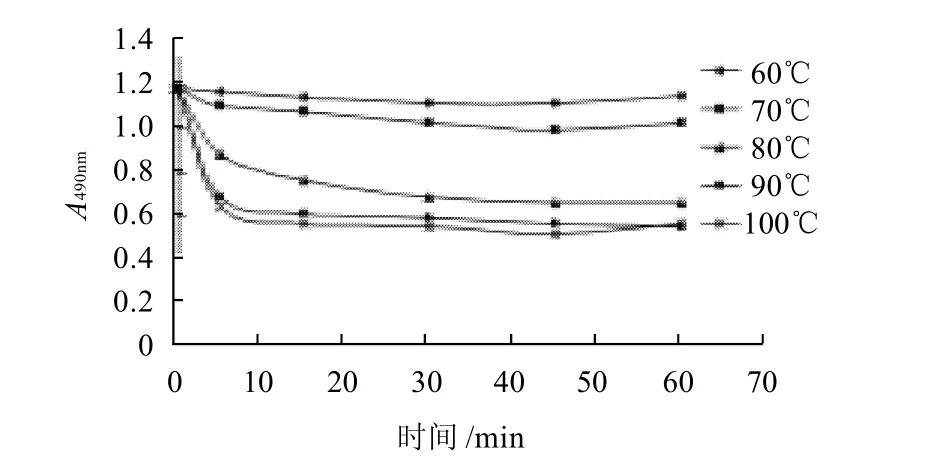
图6 90MPa处理后加热不同温度对卵白蛋白抗原性的影响Fig.6 Antigenicity change of 90 MPa treated ovalbumin during heat treatment at various temperatures
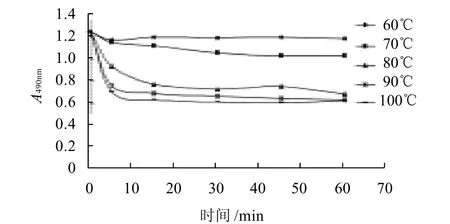
图7 180MPa处理后加热不同温度对卵白蛋白抗原性的影响Fig.7 Antigenicity change of 180 MPa treated ovalbumin during heat treatment at various temperatures
由图5~7可知,蛋清经超高压后再加热,卵白蛋白的抗原性比单纯超高压处理要低,且随温度的升高而降低。与图2比较可知,蛋清超高压后再加热,卵白蛋白抗原性在不同温度间的变化与单纯热处理的变化相似,不同的是,在70℃条件下加热并没有出现卵白蛋白抗原性较未加工样品增高的趋势,这可能因为超高压已破坏了卵白蛋白分子结构,隐藏的表位未暴露出来或蛋白分子的凝集掩盖了暴露的表位对抗原性的影响;还可以看出,蛋清超高压后再加热,卵白蛋白抗原性最高下降了52.5%,而单纯热处理样品,卵白蛋白抗原性最高下降了68%,这可能因为超高压处理对卵白蛋白分子结构产生了如2.3节所述的复杂影响,卵白蛋白分子粒度的降低促进了蛋白质与水之间的作用力,在加热时这种作用力可能对蛋白分子间凝集起一定的阻止作用。另外,在40、90、180MPa超高压处理后,冷冻保存也会影响卵白蛋白的抗原性,其数值均比未冷冻保存的数值低(图4~7)。
3 结 论
超高压及热处理对蛋清中卵白蛋白抗原性均有不同程度的影响,热处理可降低卵白蛋白抗原性,最高可降低68%,但不能达到完全消除的效果;单纯超高压对卵白蛋白抗原性的影响呈先减后增的趋势,但变化幅度仅有15%;超高压样品再加热也可降低卵白蛋白抗原性,但没有单纯热处理变化大。所以得出结论:热处理比超高压更能降低卵白蛋白抗原性。超高压处理对卵白蛋白结构的影响较复杂,曾有报道[9]指出,在800MPa压力下,卵白蛋白抗原性可降低60%。基于实验条件限制,本实验仅选择40~180MPa压力处理,更高压力处理对卵白蛋白抗原性的影响有待进一步研究;另外,蛋清样品冷冻储存所造成的对卵白蛋白抗原性的影响也有待进一步研究。
[1]ZWIETERING M. Practical considerations on food safetyobjectives[J]. Food Control, 2005, 16(9): 817-823.
[2]MINE Y, RUPA P. Immunological and biochemical properties of egg allergen[J]. World Poultry Sci J, 2004, 60: 321-330.
[3]SAMPSON H A. Update on food allergy[J]. J Allergy Clin Immunol, 2004, 113(5): 805-819.
[4]MINE Y. Recent advances in egg protein functionality in the food system[J]. Worlds Poultry Sci J, 2002, 58: 31-39.
[5]URISU A, ANDO H, MORITA Y, et al. Allergenic activity of heated and ovomucoid-depleted egg white[J]. J Allergy Clin Immunol, 1997, 100 (2): 171-176.
[6]EIGENMANN P A. Anaphylactic reactions to raw eggs after negative challenges with cooked eggs[J]. J Allergy Clin Immunol, 2000, 105(3): 587-588.
[7]WADA E, URISU A, MORITA Y, et al. Assessment of allergenic activity of heated and ovomucoid-depleted egg white[J]. Arerugi, 1997, 46 (10): 1007-1012.
[8]HILDEBRANDT S, KRATZIN H D, SCHALLER R, et al. in vitro Determination of the allergenic potential of technologically altered hen s egg[J]. J Agric Food Chem, 2008, 56(5): 1727-1733.
[9]IAMETTI S, DONNIZZELLI E, PITTIA P, et al. Characterization of high-pressure-treated egg albumen[J]. J Agric Food Chem, 1999, 47(9): 3611-3616.
[10]LOWRY O H, ROSEBROUGH N J, FARR A L, et al. Protein measurment with the Folin phenol reagent[J]. J Biol Chem, 1951, 193 (1): 265-275.
[11]解冠华, 陈红兵. 加工对牛乳过敏原的影响[J]. 食品科学, 2006, 27 (11): 598-601.
[12]KATO A, TAKAGI T. Formation of intermolecular beta-sheet structure during heat denaturation of ovalbumin[J]. Agric Biol Chem, 1988, 36 (6): 1156-1159.
[13]涂宗财, 迟海霞, 刘成梅, 等. 动态超高压微射流对卵清蛋白功能性质的影响[J]. 食品研究与开发, 2010, 31(3): 4-6.
[14]宋宏新, 梁艳. 鸡蛋清中三种主要蛋白质的连续化提取分离研究[D].西安: 陕西科技大学, 2006.
[15]魏晓芳, 刘会洲. 热变性对蛋白质结构及泡沫行为的影响[J]. 化工冶金, 2000, 21(4): 381-382.
[16]YOCUM M W, BUTTERFIELD J H, KLEIN J S, et al. Epidemiology of anaphylaxis in Olmsted County: A population-based study[J]. J Allergy Clin Immunol, 1999, 104(2 Pt 1): 452-456.
[17]王辉. 蛋清蛋白动态超高压微射流改性研究及机理初探[D]. 南昌: 南昌大学, 2007.
Respective and Combined Effects of Heat and High-pressure Treatments on the Antigenicity of Egg White Ovalbumin
ZHANG Yin1,2,TONG Ping1,3,MA Xiao-juan1,2,LI Xin1,3,CHEN Hong-bing1,3,*
(1. State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China;2. School of Life Sciences and Food Engineering, Nanchang University, Nanchang 330047, China;3. Sino-German Joint Research Institute, Nanchang University, Nanchang 330047, China)
Single heat treatment and high-pressure microfluidization and their combination were used to process egg white in order to study the effects of different processing approaches on the antigenicity of egg white ovalbumin. The results indicated that the antigenicity of heat-treated ovalbumin decreased by up to 68% with increasing temperature. The critical temperature for a steep decrease of ovalbumin antigenicity was 80 ℃. The change in antigenicity of high-pressure-treated ovalbumin exhibited an initial decrease, followed by a rebound increase. During single heat treatment and combination of heat treatment and highpressure microfludization, the antigenicity of egg white ovalbumin had a similar changing trend, but the change extent during combination of heat treatment and high-pressure microfludization was comparatively less, up to only 52.5%. Thus, heat treatment had more effect on ovalbumin antigenicity than high-pressure microfluidization. This conclusion is helpful for the development of hypoallergenic or non-allergenic egg products.
heat treatment;high-pressure microfludization;ovalbumin;egg allergy
Q518.4
A
1002-6630(2010)19-0250-04
2010-06-27
教育部“新世纪优秀人才支持计划”项目(NCET-08-07-04);南昌大学食品科学与技术国家重点实验室自由探索项目(SKLF-TS-200820);江西省自然科学基金项目(2008GZN0040)
张银(1987—),女,硕士研究生,研究方向为食品卫生与安全。E-mail:zhangyin221@126.com
*通信作者:陈红兵(1967—),男,教授,博士,研究方向为食品生物技术。E-mail:chbgjy@hotmail.com



