王瑛瑶,魏翠平,栾 霞,张霜玉,杜传林
(国家粮食局科学研究院,北京 100037)
菜籽水解蛋白的组成及性质研究
王瑛瑶,魏翠平,栾 霞,张霜玉,杜传林
(国家粮食局科学研究院,北京 100037)
对水酶法提油技术得到的菜籽水解蛋白的组成、物化性能及体外功能特性进行研究。菜籽水解蛋白主要由粗蛋白质、总糖和灰分组成,含量分别为54.95%、28.83%、14.82%,粗蛋白中疏水性氨基酸含量为37.21g/100g。菜籽水解蛋白具有良好的溶解性和高质量浓度下保持流动的特性。水解蛋白体外还原能力和清除自由基能力显着,具有体外抗氧化活性。
菜籽水解蛋白;组成;物化性能;抗氧化活性
Abstract:The chemical composition, physico-chemical properties andin vitrofunctional properties of the rapeseed protein hydrolysates (RPHs) left after aqueous enzymatic extraction of oil were studied. The hydrolysates mostly consisted of protein,carbohydrate and ash, and the contents were 54.95%, 28.83% and 14.82%, respectively. The hydrophobic amino acid content was 37.21 g/100 g protein. The hydrolysates had an excellent solubility and lower viscosity at high concentration. Their reducing power and abilities to scavenge DPPH and hydroxyl free radicals were all obvious, indicating good antioxidant effectin vitro.
Key words:rapeseed protein hydrolysates;composition;physico-chemical properties;antioxidant activity
水酶法提油作为一种新兴的非有机溶剂提油技术,是当前国际油脂界的研究热点[1]。其除了具有操作安全、低能耗等优势以外,在制取植物油脂的同时,可同步回收其中的蛋白质及碳水化合物类物质。研究这些产物的性质,从而开发其利用方式,对推进油料水酶法提油技术的实际应用具有十分重大的科学与现实意义。
油菜籽是我国优势油料资源,种植面积约700万公顷,产量约1300万t[2]。油菜籽富含油脂和蛋白质,长期以来,由于传统制油工艺及油菜籽原料中硫苷等抗营养因子的限制,我国对菜籽蛋白及菜籽水解蛋白的研究报道还不多。本研究在水酶法提取油菜籽中油脂的基础上[3],系统研究了另一产物——菜籽水解蛋白的组成、储存稳定性及体外功能性质,以期为水酶法提油工艺得到的水解蛋白这一产物的功能特性、抗氧化性质研究及产品应用开发提供参考。
1 材料与方法
1.1 材料与试剂
菜籽水解蛋白粉(水解度为19.28%)按水酶法提油工艺制备[3]。
DPPH(1,1-diphenyl-2-picryl-hydrazyl) 日本东京化成工业株式会社。
1.2 仪器与设备
RJ-LD-IIB型低速大容量多管离心机 无锡市瑞江分析仪器有限公司; SHZ-88台式水浴恒温振荡器 江苏太仓市实验设备厂;L-117型实验室喷雾干燥塔 瑞士步旗公司;Agilentll00氨基酸自动分析仪 安捷伦公司;XW-80A旋涡混合仪 海门市其林贝尔仪器制造有限公司;NDJ-5S数字旋转黏度计 上海青浦沪西仪器厂;CR-400色差计 柯尼卡-美能达公司;DRC Ⅱ型l ICPMS 美国Perkin Elmer公司。
1.3 方法
1.3.1 菜籽水解蛋白的组成
1.3.1.1 成分分析
蛋白质含量的测定:GB/T5009.5—2003《食品中蛋白质的测定》凯式定氮法;总糖含量的测定:苯酚-硫酸法[4];灰分的测定:GB/T5009.4—2003《食品中灰分的测定》质量法;游离氨基酸含量测定:茚三酮比色法[4];粗脂肪测定:GB/T5009.6—2003《食品中脂肪的测定》索式抽提法。
1.3.1.2 氨基酸组成分析
样品前处理后,采用氨基酸自动分析仪测定。分析仪条件:可见光检测器,波长:570nm(蛋白质采用440nm波长测定);离子交换柱:2.6mm×150mm;流速:0.225mL/min;流动相:柠檬酸和柠檬酸钠的缓冲液;进样量:50μL。
1.3.1.3 金属元素含量测定
按文献[5]方法处理样品,电感偶合等离子体参数:功率1100W;冷却气流量(Ar) 15.0L/min;辅助气流量(Ar) 0.90L/min;载气流量(Ar) 0.90L/min。质谱仪参数:分析室真空为12Pa,分辨率(10%峰高)0.8unit,停留时间90ms,重复次数6,测量点峰2,循环次数6,测量方式为质量扫描;样品提升量1mL/min。金属元素含量表示为mg/kg样品。
1.3.2 菜籽水解蛋白理化性质的测定
1.3.2.1 溶解性[6]
以氮溶解指数(NSI)作为菜籽水解蛋白溶解性指标。依据AACC 46-23.01测定不同pH 值下样品的NSI 值。
1.3.2.2 菜籽水解蛋白溶液黏度
25℃条件下,用旋转黏度计测定质量浓度为2、5、10、15、20、30、40、50g/100mL的菜籽水解蛋白水溶液的黏度。
1.3.3 菜籽水解蛋白体外功能特性研究
1.3.3.1 菜籽水解蛋白还原能力[7]
取1mL一定质量浓度的样品加入2.5mL pH6.6的磷酸缓冲液(0.2mol/L)和2.5mL 1g/100mL的铁氰化钾溶液,混匀,在50℃水浴中保温20min,加入2.5mL 10g/100mL的三氯乙酸,混合后以3000r/min离心10min。取上清液2.5mL和0.5mL 0.1g/100mL的氯化铁混合均匀,静置30min,700nm波长处测定混合液的吸光度。吸光度越大,表示还原能力越强。
1.3.3.2 菜籽水解蛋白清除DPPH自由基能力[8]
取0.2mL一定质量浓度的样品,加入5.5mL 0.065mmol/L DPPH溶液(以无水乙醇配制),混合均匀后黑暗处避光反应30min,以0.2mL样品和5.5mL无水乙醇混合后的溶液作为空白调零,在520nm波长处测定吸光度。
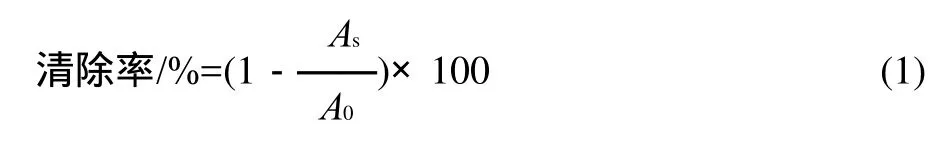
式中:As代表样品和 DPPH混合液的吸光度;A0代表溶剂和DPPH混合液的吸光度。
1.3.3.3 菜籽水解蛋白清除·OH能力[9]
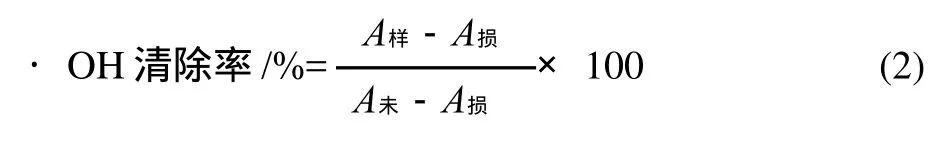
用磷酸缓冲液将样品配制成不同质量浓度。取lmL 0.75mmol/L的邻二氮菲无水乙醇溶液于试管中依次加入2mL磷酸缓冲液(pH7.40,0.2mol/L)和lmL H2O,充分混匀后,加入lmL 0.75mmol/L FeSO4溶液,混匀后,加入lmL 0.01% H2O2,于37℃水浴60min后,在536nm波长处测其吸光度,所测得的数据为损伤管的吸光度A损。未损伤管以lmL H2O代替损伤管中lmL0.01%的H2O2,操作方法同损伤管,可测得536nm波长处未损伤管的吸光度A未。样品管以lmL样品代替损伤管中的lmL H2O,操作方法同损伤管,测得536nm波长处样品的吸光度A样。清除率按式(2)计算。
2 结果与分析
2.1 菜籽水解蛋白的组成
水解度为19.28%的菜籽水解蛋白的组分分析见表1,水酶法提油中蛋白酶对菜籽蛋白的降解及油脂的分离使得水解蛋白这一产物中粗蛋白含量较高(54.95%)。其次,就是占干基28.83%的总糖,这部分碳水化合物主要来源于原料中的可溶性糖及淀粉、果胶、纤维素等的降解。工艺中酸碱pH值条件调节过程引入了一定的盐分,使得水解蛋白的灰分达到了14.82%,这将给其在食品领域的应用带来一定的限制。水解蛋白粉中游离氨基酸含量为2.30%,以蛋白质基计,仅占总蛋白含量的4.18%,表明选用的酶主要以内切方式(endo-)对菜籽蛋白进行作用。水酶法从菜籽中提油的另一产物——水解蛋白的蛋白质含量高。测定其氨基酸组成。

表1 菜籽水解蛋白的成分分析(以干基计)Table 1 General chemical composition of RPHs
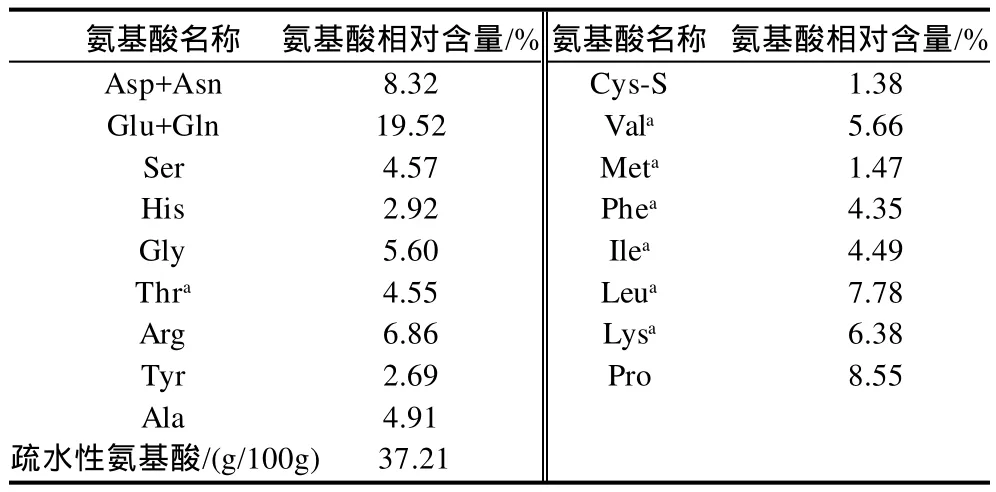
表2 菜籽水解蛋白的氨基酸组成Table 2 Amino acid composition of RPHs
由表2可知,主要氨基酸为Glu、Asp、Leu和Arg,其相对含量分别占19.52%、8.32%、7.78%和6.86%;必需氨基酸与非必需氨基酸比例为0.51。有研究表明[10],疏水性氨基酸含量与样品的抗氧化活性及清除自由基能力之间有一定的正相关性,水解蛋白的疏水性氨基酸含量为37.21g/100g,这为开展其抗氧化性能与清除自由基能力等体外活性研究提供了潜在结构基础。
水酶法提油工艺中由于调节体系pH值所需,不断引入一些酸碱试剂,使得菜籽水解蛋白中灰分含量高达14.82%。测定水解蛋白中的金属元素含量,结果见表3,除了Na、K、Mg和Ca含量高以外,水解蛋白中过渡金属离子Cu和Fe含量也较高。章邵兵[11]采用类似水酶法工艺制备得到的菜籽蛋白水解物灰分含量为9.17%,总糖含量为19.75%,比本实验所测灰分和糖含量低,这是工艺中使用的酶种类不同所致。
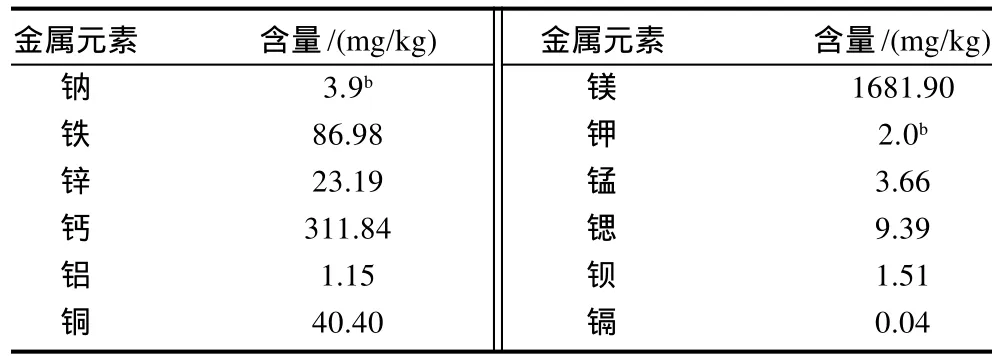
表3 菜籽水解蛋白的金属元素组成Table 3 Metal element composition of RPHs
2.2 菜籽水解蛋白的理化性质
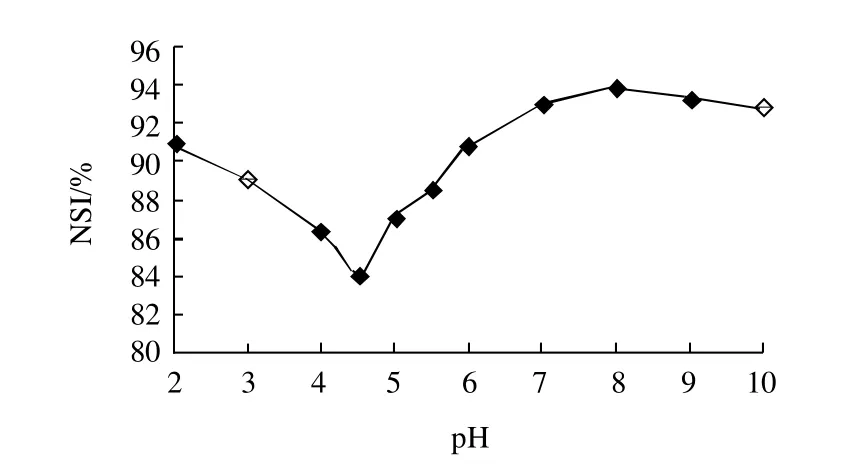
图2 不同pH值菜籽水解蛋白的溶解特性Fig.2 Solubility of RPHs at different pH values
水解蛋白的溶解性是其最重要的物化性质之一,具有优越的溶解性是蛋白及肽发挥诸多功能应用所必须的。从图2可知,菜籽水解蛋白具有宽泛pH值范围内良好的溶解性能,即使在菜籽蛋白等电点4.5附近,菜籽水解蛋白的NSI也达到84%,这是由于酶解作用使菜籽蛋白的平均分子质量和尺寸降低,形成更多亲水性和可溶剂化的肽单元。菜籽水解蛋白良好的溶解性能使其在不同领域的应用成为可能,诸如在食品中应用,可为终产品提供易接受的外观和丝滑的口感。
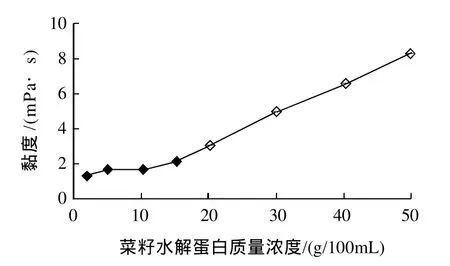
图3 不同质量浓度菜籽水解蛋白的黏度Fig.3 Viscosity of RPHs at different concentrations
不同质量浓度菜籽水解蛋白的黏度变化见图3。菜籽水解蛋白溶液黏度随质量浓度增加变化不大,流动性极好,在50g/100mL质量浓度时仍富有流动性。
2.3 菜籽水解蛋白体外抗氧化活性的研究
2.3.1 菜籽水解蛋白的还原能力
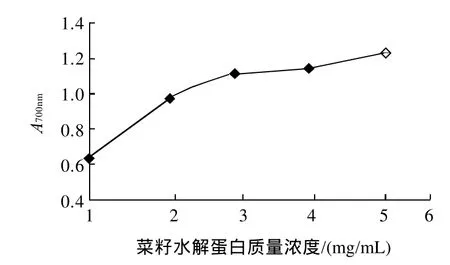
图4 菜籽水解蛋白的质量浓度与还原能力的关系Fig.4 Concentration dependence of reducing power of RPHs
研究表明,抗氧化剂的还原力与其抗氧化性之间存在联系,抗氧化剂通过给出电子和质子氢,从而起到清除自由基的作用[12]。因此,可以通过测定菜籽水解蛋白对Fe3+的还原力来评价其抗氧化性的强弱,还原力越强,抗氧化性越强。
还原能力测定中,测试体系中的还原剂(抗氧化剂)将Fe3+还原成Fe2+形式,减少了Fe3+/[Fe(CN)6]3-络合物的量,在700nm波长处比色测定形成的普鲁士蓝可以监测形成的Fe2+。从图4可知,菜籽水解蛋白在低质量浓度时(1mg/mL)就显示显着的还原能力(P<0.05),且呈显着的量效关系。这表明,菜籽水解蛋白中可能含有作为电子供体、可与自由基反应形成更稳定结构的肽等抗氧化成分。
2.3.2 菜籽水解蛋白清除自由基能力
DPPH自由基分析法是测定自由基能力的常用方法,稳定的DPPH自由基呈深紫色,因其具有单电子而在517nm波长处具有强吸收,DPPH自由基接受了其他物质提供的电子后会形成稳定的反磁体分子并且吸收会消失,紫色逐渐消失,其褪色程度与其接受的电子数成定量关系[13]。通过DPPH自由基体系中吸光度变化可以衡量样品清除自由基的能力,从而评价样品的抗氧化能力。
在生命活动的氧化代谢过程中不断产生各种自由基,其中·OH是体内最活泼的活性氧,它几乎可以和所有的细胞成分发生反应,引起膜脂、蛋白质和核酸的氧化损伤,导致细胞衰老、死亡和机体病变[14]。

表4 菜籽水解蛋白清除自由基能力Table 4 Free radical scavenging capacities of RPHs
由表4可知,在本实验所测定的质量浓度范围内,菜籽肽显示了显着的清除DPPH自由基和·OH能力,并且清除自由基能力随质量浓度的增加而增强。朱艳华等[15]报道玉米多肽在质量浓度0.05~5mg/mL范围内,对DPPH自由基清除率最高为57.59%。菜籽水解蛋白在质量浓度为15mg/mL时对DPPH自由基的清除率达到69.5%,高于同等质量浓度下玉米多肽对DPPH自由基的清除能力。菜籽水解蛋白清除自由基的作用机制很可能是直接提供质子和自由基反应后将其转变为更为稳定的物质,而发挥自身清除自由基的能力。
3 结 论
水酶法提油得到的菜籽水解蛋白是富含蛋白质和多糖的混合物,疏水性氨基酸含量达到37.21g/100g(以蛋白质基计),水解蛋白中的金属元素主要是Na、K、Mg和Ca。菜籽水解蛋白具有良好的溶解能力和高质量浓度下保留流动的物化性能,体外实验中,显示了优良的还原能力和清除多种自由基的能力,说明其具有良好的抗氧化特性。
[1] MOREAU R A, DICKEY L C, JOHNSTON D B, et al. A process for the aqueous enzymatic extraction of corn oil from dry milled corn germ and enzymatic wet milled corn germ (E-germ)[J]. J Am Oil Chem Soc, 2009,86(5):469- 474.
[2] 国家粮油信息中心. 2009年油菜籽产量预测增幅下调至7.4%[EB/OL](2009-6-13)[2010-05-01]. http://www.chinagrain.cn/caizi/2009/6/13/2009613837555634.html.
[3] 张霜玉, 王瑛瑶, 陈光, 等. 水酶法从油菜籽中提取油及水解蛋白的研究[J].中国油脂, 2009, 34(1):30-33.
[4] 大连轻工业学院, 华南理工大学, 郑州轻工业学院, 等. 食品分析[M].北京:中国轻工业出版社, 1994.
[5] 陶海腾, 张春江, 陈晓明, 等. ICP-MS测定木薯生产副产物的矿质元素和有害重金属元素[J]. 光谱学与光谱分析, 2009, 29(17):1983-1985.
[6] AACC International. Approved methods of analysis, Method 46-23.01[S].
[7] 王海敏, 虞海霞, 董蕊, 等. 苕子蜜总酚酸和总黄酮含量测定及抗氧化活性的研究[J].食品科学, 2010, 31(1):54-57.
[8] THIANSILAKUL Y, BENJAKUL S, SHAHIDI F. Compositions, functional properties and antioxidative activity of protein hydrolysates prepared from round scad (Decapterus maruadsi)[J]. Food Chemistry,2007, 103:1385-1394.
[9] de AVELLAR I G, MAGALHAES M M, SILVA A B, et al. Reevaluating the role of 1,10-phenanthroline in oxidative reactions involving ferrous ions and DNA damage[J]. Biochimica et Biophysica Acta, 2004, 1675:46-53.
[10] LI Yanhong, JIANG Bo, ZHANG Tao, et al. Antioxidant and free radical-scavenging activities of chickpea protein hydrolysate (CPH)[J]. Food Chemistry, 2008, 106:444-450.
[11] 章绍兵. 水酶法从油菜籽中提取油和生物活性肽的研究[D]. 无锡:江南大学, 2008.
[12] 曹炜, 卢珂, 陈卫军. 不同种类蜂蜜抗氧化活性的研究[J]. 食品科学,2005, 26(8):352-356.
[13] ATMANI D, CHAHER N, BERBOUCHA M, et al. Antioxidant capacity and phenol content of selectedAlgerian medicinalplants[J]. Food Chemistry, 2008, 112(2):303-309.
[14] DREHER D, JUNOD A E. Role of oxygen free radicals in cancer development[J]. Euro J Cancer, 1996, 32(1):30-35.
[15] 朱艳华, 谭军. 玉米多肽抗氧化作用的研究[J]. 中国粮油学报, 2008,23(1):36-38.
Chemical Composition and Functional Properties of Rapeseed Protein Hydrolysates Left after Aqueous Enzymatic Extraction of Oil
WANG Ying-yao,WEI Cui-ping,LUAN Xia,ZHANG Shuang-yu ,DU Chuan-lin
(Academy of State Administration of Grain, Beijing 100037, China)
Q816
A
1002-6630(2010)21-0072-04
2010-05-12
“十一五”国家科技支撑计划项目(2009BABD1B0305)
王瑛瑶(1978—),女,副研究员,博士,主要从事粮油食品加工研究。E-mail:wyy@chinagrain.org



