于丽娜,高俊安,杨庆利,*,孙 杰,毕 洁,张初署,刘少芳
(1.山东省花生研究所,山东 青岛 266100;2.山东世纪春食品有限公司,山东 临沂 276400)
不同处理条件对花生抗氧化肽抗氧化活性的影响
于丽娜1,高俊安2,杨庆利1,*,孙 杰1,毕 洁1,张初署1,刘少芳1
(1.山东省花生研究所,山东 青岛 266100;2.山东世纪春食品有限公司,山东 临沂 276400)
以花生蛋白粉为原料,采用Viscozyme L预水解,Alcalase水解法制备花生抗氧化肽。通过7种不同的处理条件(加热、食品添加剂、防腐剂、金属离子、杀菌、调pH值、低温)对花生抗氧化肽的4种体外抗氧化指标(清除DPPH自由基、还原力、铁离子螯合力、抗脂质体过氧化能力)进行研究。结果显示:加热处理和添加食品防腐剂有利于提高抗氧化肽的抗氧化活性;添加酒石酸、柠檬酸对抗氧化活性有较大影响,而添加氯化钠和蔗糖后对抗氧化活性影响小;添加铜离子对抗氧化活性影响较大;各种杀菌工艺有利于清除DPPH自由基、还原力、铁离子螯合力,但却降低脂质过氧化抑制率;碱性pH值条件有利于提高抗氧化肽的还原力、铁离子螯合力和脂质过氧化抑制力,酸性pH值条件不利于铁离子螯合力和脂质过氧化抑制力;低温处理降低抗氧化肽抗氧化活性。
Viscozyme L;Alcalase;花生抗氧化肽;不同处理条件;抗氧化活性
食品中脂质易发生过氧化反应,从而生成一系列过氧化产物,它们破坏食品的营养价值,缩短食品的货架期,甚至引起“三高”等现代文明病[1],因此,通常使用抗氧化剂来抑制脂质的过氧化作用。目前,使用的抗氧化剂有两大类:天然抗氧化剂和合成抗氧化剂。近年来,大多数合成抗氧化剂如丁基羟基茴香醚(BHA)、二丁基羟基甲苯(BHT)已经被证实对人体肝、脾、肺有毒害作用,并具有蓄积性致癌作用,一些国家已经禁止或限制应用在食品中[2]。于是,天然抗氧化剂如抗坏血酸、茶多酚、茶多糖、原花青素、类黄酮、白藜芦醇、水溶性膳食纤维、抗氧化肽等成为食品科学、食品化学、生化营养学、流行病学、预防医学等学科研究的热点[3-5]。其中,抗氧化肽属于蛋白质类物质,除了具有清除自由基和抑制脂质过氧化活性外,还能赋予食品额外的营养价值和功能性质,它有望开发成为新型的功能食品原料[6]。
抗氧化肽应用到食品体系中,其抗氧化活性就要受到食品加工方式、贮运条件、成分、添加剂、酸碱性、包装材料等的影响,有必要研究在这些条件下的其体外抗氧化活性。本实验运用植物复合水解酶Viscozyme L预水解花生蛋白粉,再应用碱性蛋白酶Alcalase水解法制备花生抗氧化肽。采用4类体外抗氧化活性实验[7]:清除DPPH自由基、还原力、铁离子螯合力、抗脂质体过氧化,研究花生抗氧化肽在加热处理、食品添加剂、食品防腐剂、金属离子、杀菌工艺、调pH值、低温等条件下的抗氧化活性的变化情况,旨在为花生抗氧化肽作为功能食品原料应用到食品中提供理论依据。
1 材料与方法
1.1 材料与试剂
低变性脱脂花生蛋白粉 山东天申生物蛋白有限公司。
Viscozyme L (100FBG/g)、Alcalase 2.4L(2×105U/g)丹麦Novozyme公司;1,1-二苯基-2-三硝基苯肼(DPPH)、菲洛嗪(Ferrozine)、L-α-磷脂酰胆碱(大豆提取)、L-抗坏血酸 美国Sigma公司;FeCl3、K3Fe(CN)6、三氯乙酸(TCA)、FeCl2、硫代巴比妥酸(TBA)、HCl均为分析纯 上海国药集团化学试剂有限公司。
1.2 仪器与设备
FD-1C-50冷冻干燥机 北京博医康实验仪器有限公司;SHA-B双功能恒温水浴振荡器 金坛市杰瑞尔电器有限公司;FE20实验室pH计 梅特勒-托利多仪器有限公司;CR22GⅡ高速冷冻离心机 日本Hitachi公司。
1.3 花生抗氧化肽制备工艺
花生蛋白粉加入600mL蒸馏水,超声溶解30min,用0.5mol/L盐酸溶液调节pH值到5.00,加入Viscozyme L酶液2.4mL,45℃恒温水浴振荡器中酶解120min。反应结束后,90℃水浴灭酶20min。用0.5mol/L氢氧化钠溶液调节pH值至8.20,加入Alcalase酶液9.6mL,50℃恒温水浴振荡器中酶解94min。反应结束后,100℃水浴灭酶10min。在20℃条件下,以4500r/min离心10min,上清液在冷冻干燥机中冻干,保存到-20℃冰箱中,备用。
1.47 种不同处理条件的实验方法
花生抗氧化肽溶液分别进行以下操作:1)加热处理:20、40、60、80、100℃的水浴中分别静置30min;2)添加食品添加剂:不添加任何添加剂、1g/100mL氯化钠、4g/100mL蔗糖、8g/100mL葡萄糖、0.2g/100mL柠檬酸、0.2g/100mL酒石酸;3)添加食品防腐剂:不添加任何防腐剂、分别添加0.001g/100mL苯甲酸、苯甲酸钠、山梨酸钾、丙酸钙和焦亚硫酸钠;4)添加金属离子:不添加任何金属盐、分别添加0.001g/100mL硫酸钾、氯化钙、氯化镁、硫酸锌、硫酸铜;5)不同杀菌工艺:加入8g/100mL葡萄糖、0.1g/100mL柠檬酸和0.1g/100mL酒石酸后做以下处理:不进行任何处理;微波灭菌:以微波功率800W、100℃、5min;巴氏灭菌:63℃水浴中恒温30min;煮沸灭菌:100℃水浴中恒温10min;高温短时杀菌:11 0℃油浴中恒温1min;高压蒸汽灭菌:高压灭菌锅121℃、0.1MPa、加热15min;6)不同 pH值:分别用0.5mol/L盐酸溶液或0.5mol/L氢氧化钠溶液调节pH值至3、5、7、9、11;7)低温处理:分别在室温、4、-20℃条件下静置24h;各种操作结束后测定4个抗氧化活性(DPPH自由基清除率、还原力、铁离子螯合率、抗脂质体过氧化活性)指标。
1.5 抗氧化活性测定
1.5.1 DPPH自由基清除率的测定[8]
加入2mL样品和2mL DPPH无水乙醇溶液(2.5mmol/L),混合均匀后反应20min,3000r/min离心10min,上清液在517nm波长处测吸光度,记为Ai。DPPH自由基清除率按式(1)计算。

式中:Aj为加入2mL样品和2mL无水乙醇时测定的吸光度;A0为加入2mL DPPH无水乙醇溶液(2.5mmol/L)和2mL蒸馏水时测定的吸光度。
1.5.2 还原力的测定[9]
取1mL样品液加入0.1mol/L磷酸盐缓冲液(pH6.6)和1g/100mL K3Fe(CN)6溶液各2.5mL,50℃水浴20min,加入2.5mL 10g/100mL消TCA溶液,3000r/min离心10min,取上清液2.5mL加入2.5mL蒸馏水和0.5mL的0.1g/100mL FeCl3溶液,静置10min。以参比液调节零点,在700nm波长处测定吸光度。
1.5.3 铁离子螯合率的测定[10]
取1mL样品加入2.7mL去离子水和0.1mL FeCl2溶液(2mmol/L),混匀后加入0.2mL Ferrozine(5mmol/L),静置10min。在562nm波长处测定吸光度(A)。按公式(2)计算铁离子螯合率。

式中: A0为空白对照组即以1mL双蒸水代替样品的吸光度。
1.5.4 脂质过氧化抑制率的测定[11]
取1.0mL L-α-磷脂酰胆碱溶液、1.0mL 0.4mmol/L FeCl3溶液、1.0mL 0.4mmol/L L-抗坏血酸溶液和1.0mL样品,混匀后37℃水浴60min(避光),加入2.0mL TCA-TBAHCl混合液(15g的TCA、0.375g TBA、2.1mL浓盐酸依次序放入100mL蒸馏水中,混合均匀),95℃水浴15min,3000r/min离心10min,取上清液在535nm波长处测吸光度(A)。对脂质体过氧化的抑制率按式(3)计算。

式中:A0为空白对照组即以1mL蒸馏水代替样品的吸光度。
2 结果与分析
2.1 加热处理对花生抗氧化肽抗氧化活性的影响

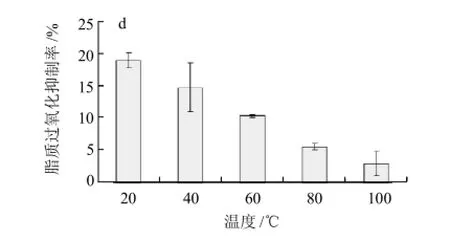
图1 加热处理对花生抗氧化肽抗氧化活性的影响Fig.1 Effect of heat treatment on antioxidant activity of peanut antioxidant peptide
由图1a可知,DPPH自由基清除率随温度的升高呈先不变后增加的趋势,100℃加热处理的抗氧化肽有最大的清除率。抗氧化肽的抗氧化活性与3类氨基酸(疏水性氨基酸、抗氧化性氨基酸和酸性氨基酸)及其空间构象有关[12]。经过加热处理,尤其是高温处理后,抗氧化肽的空间构象可能改变,使得上述3类氨基酸易与DPPH自由基接触,从而提供较多的电子与DPPH自由基单电子配对,则DPPH自由基清除率增加。还原力能用来衡量抗氧化物质供电子能力的强弱[13]。图1b显示,经过80℃和100℃加热处理的抗氧化肽的还原力大于20℃处理的,这也是因为高温处理改变了抗氧化肽的空间构象,使得供电子能力增加导致还原能力增大。图1c显示,40~100℃加热处理的铁离子螯合率都远大于20℃处理的螯合率。这是因为加热处理后抗氧化肽的构象改变,使得抗氧化性氨基酸组氨酸容易与反应体系中的Fe2+结合,组氨酸上的α-氨基和羧基与Fe2+形成五元环,α-氨基和咪唑基与Fe2+形成六元环,羧基和咪唑基与Fe2+形成七元环[14],导致反应体系中的Fe2+减少,则螯合率增加。图1d显示,随着温度的升高,抑制率呈直线下降的趋势。加热处理改变了抗氧化肽的空间构象,使其不能及时的清除反应体系中的自由基。而脂质过氧化反应是自由基连锁反应,只需少数几个自由基引发剂就能导致数以千计的多不饱和脂肪酸分子发生反应[15],因此,加热处理条件下,对脂质过氧化的抑制率减小。
2.2 食品添加剂对花生抗氧化肽抗氧化活性的影响
由图2a可知,加入葡萄糖、酒石酸、氯化钠和蔗糖后,DPPH自由基清除率略有减小,但加入柠檬酸后,DPPH自由基清除率显着减小,仅为对照样品的3.1%。可能原因是柠檬酸是一种较强的有机酸,它的加入会影响花生抗氧化肽的供电子能力,导致清除DPPH自由基效果下降。同理,由图2b可知,加入柠檬酸的还原力减小,而加入其他添加剂的还原力,葡萄糖没有显着改变还原力,其他添加剂使还原力增大。其中,加入酒石酸使样品还原力显着增加,是对照样品的2.6倍,主要因为酒石酸是一种还原剂,它可以大幅度提高反应体系的还原能力。由图2c可知,加入氯化钠和蔗糖的铁离子螯合率变化不大;加入柠檬酸的螯合率显着增加,可能是因为柠檬酸的3个羧基有利于抗氧化肽中组氨酸与Fe2+形成五元环和七元环所致;加入葡萄糖的螯合率略微减小;而加入酒石酸的样品失去对铁离子螯合能力,酒石酸能与多种金属离子络合,在反应体系中它与Fe2+络合作用强于抗氧化肽与Fe2+螯合作用,所以,抗氧化肽失去与Fe2+螯合的机会,导致没有螯合作用。由图2d可知,加入葡萄糖、柠檬酸、氯化钠后,抑制率增大;加入蔗糖后抑制率减小;加入酒石酸后,抗氧化肽对脂质过氧化没有抑制效果。

图2 食品添加剂对花生抗氧化肽抗氧化活性的影响Fig.2 Effect of food additive on antioxidant activity of peanut antioxidant peptide
2.3 食品防腐剂对花生抗氧化肽抗氧化活性的影响

图3 食品防腐剂对花生抗氧化肽抗氧化活性的影响Fig.3 Effect of food preservative on antioxidant activity of peanut antioxidant peptide
由图3可知,DPPH自由基清除率和还原力结果(图3a和3b)显示,加入5种防腐剂后DPPH自由基清除率和还原力都增加,其中,加入焦亚硫酸钠的还原力增加最明显,其吸光度是不加任何防腐剂样品的3.6倍。原因是焦亚硫酸钠是一种还原剂,它本身能促进反应体系的吸光度增大。加入5种防腐剂后,抗氧化肽对铁离子螯合率都减小(图3c)。抑制脂质过氧化反应结果(图3d)中,除了加入山梨酸钾的抗氧化肽对脂质过氧化抑制率减小外,其余都增大。
2.4 金属离子对花生抗氧化肽抗氧化活性的影响

图4 金属离子对花生抗氧化肽抗氧化活性的影响Fig.4 Effect of metal ion on antioxidant activity of peanut antioxidant peptide
由图4可知,DPPH自由基清除率(图4a)和还原力(图4b)在加入金属离子后,除了加入硫酸锌的还原力明显减小外,其余各组实验结果变化不大,说明金属离子对这两种抗氧化活性没有影响。铁离子螯合率结果(图4 c)中,加入氯化钙、硝酸镁、硫酸锌后螯合率下降;加入硫酸钾和硫酸铜后螯合率增大,且加入硫酸铜后螯合率增大最显着,是对照样品螯合率的2.3倍,可能原因是硫酸铜的水溶液呈弱酸性,使得抗氧化肽的组氨酸残基的咪唑基接受质子,易与Fe2+形成六元环和七元环,从而提高对Fe2+螯合能力。抑制脂质过氧化结果显示(图4d),除了加入硫酸钾的抑制率减小外,加入其他金属离子的抑制率都增大,其中,加入硫酸铜后抑制率增大最显着,是对照样品抑制率的3.7倍。
2.5 不同杀菌工艺对花生抗氧化肽抗氧化活性的影响

图5 不同杀菌工艺对花生抗氧化肽抗氧化活性的影响Fig.5 Effect of sterilization on antioxidant activity of peanut antioxidant peptide
由图5a可知,除了高压蒸汽灭菌的样品清除率没有变化外,其他杀菌工艺的清除率都有增加,其中,微波灭菌增大最多。其原因是5种杀菌工艺都有不同程度的加热过程,抗氧化肽在加热处理后空间构象会有改变,同2.1节结果一样,使得疏水性氨基酸、抗氧化性氨基酸和酸性氨基酸提供较多的电子与DPPH自由基的氮原子的单电子配对,从而增加清除率。由图5b可知,巴氏灭菌、煮沸灭菌和高温短时杀菌工艺样品的还原力都略有减小,而微波灭菌和高压蒸汽灭菌样品的还原力均增大,高压蒸汽灭菌样品的还原力是对照组品的2.3倍,可能是样品经过高压蒸汽灭菌处理后部分抗氧化肽发生美拉德反应,而美拉德反应产物具有还原力,致使反应体系还原力大幅增加。由图5c可知,5种杀菌工艺的样品的铁离子螯合率都大于对照样品,其中,煮沸灭菌样品的螯合率是对照组样品的1.6倍。由图5d可知,5种杀菌工艺样品的抑制率都减小,其中,微波灭菌样品的抑制率最小,仅为不经过杀菌处理样品的16.7%。经过5种杀菌工艺处理,抗氧化肽的空间构象改变而不能及时清除反应体系中的自由基,导致对脂质过氧化抑制能力下降,这个结果与2.1节中一致。
2.6 pH值对花生抗氧化肽抗氧化活性的影响


图6 pH值对花生抗氧化肽抗氧化活性的影响Fig.6 Effect of pH on antioxidant activity of peanut antioxidant peptide
由图6a可知,pH3~7的样品对DPPH自由基清除效果较好,碱性条件下清除率较小。由图6b可知,随着pH值的增加,样品还原力呈现先增大后减小趋势,总体来看,碱性条件下样品的还原力较大。由图6c和6d可知,酸性pH值条件下,样品失去这两种抗氧化能力,而中性和碱性条件下较好,尤其在碱性条件下,样品的铁离子螯合率和脂质过氧化抑制率都较大。可能原因是溶液的pH值会影响抗氧化肽的空间构象,酸性pH值使抗氧化肽的极性氨基酸暴露出来,阻碍疏水性氨基酸和抗氧化性氨基酸发挥抗氧化活性,而碱性pH值有助于上述氨基酸残基的抗氧化活性。因此,碱性pH值条件下,抗氧化肽的还原力、螯合金属离子能力和抑制脂质过氧化能力都较好。
2.7 低温处理对花生抗氧化肽抗氧化活性的影响


图7 低温处理对花生抗氧化肽抗氧化活性的影响Fig.7 Effect of low temperature treatment on antioxidant activity of peanut antioxidant peptide
由图7可知,低温处理后,样品除了对DPPH自由基清除率没有变化外,其余3种抗氧化能力均减少。4℃处理的抗氧化肽相对于常温下的样品的还原力减小8.6%、铁离子螯合率减小34.5%、脂质过氧化抑制率减小24.4%。-20℃处理的这3个值分别减小13.1%、42.4%和22.6%。总体来看,-20℃处理对抗氧化肽抗氧化活性的影响要大于4℃的。可能原因是低温处理,尤其是冷冻状态下,抗氧化肽分子周围的水分子不断冻结,使得抗氧化肽的空间结构发生改变,部分极性基团暴露在周围环境中,从而阻碍了疏水性氨基酸、抗氧化性氨基酸和酸性氨基酸发挥抗氧化活性,导致还原力、金属离子螯合力和抑制脂质过氧化能力下降。
3 结 论
以低变性花生蛋白粉为原料,超声波分散溶解和Viscozyme L水解蛋白粉后,采用Alcalase水解制备花生抗氧化肽。研究了加热处理、食品添加剂、食品防腐剂、金属离子、杀菌工艺、pH值和低温处理7个条件下花生抗氧化肽抗氧化活性的变化情况。加热处理有利于提高抗氧化肽的抗氧化活性(DPPH自由基清除率、还原力和铁离子螯合率增大)。添加酒石酸、柠檬酸对抗氧化活性有较大影响(添加酒石酸的还原力增加显着,螯合能力和抑制脂质过氧化能力丧失;添加柠檬酸的铁离子螯合率增加显着,DPPH自由基清除率和还原力下降显着),添加氯化钠和蔗糖的抗氧化活性没变化。添加食品防腐剂可提高抗氧化活性(DPPH自由基清除率、还原力和脂质过氧化抑制率增大)。添加铜离子对抗氧化活性影响较大(铁离子螯合率和脂质过氧化抑制率显着增大)。各种杀菌工艺能降低脂质过氧化抑制率。除了DPPH自由基清除活性外,碱性pH值条件有利于提高其他抗氧化活性,而酸性pH值条件不利于铁离子螯合和抑制脂质过氧化活性。低温处理能降低抗氧化肽抗氧化活性。
[1]REN Jian, ZHENG Xiqun, LIU Xiaolan, et al. Purification and characterization of antioxidant peptide from sunflower protein hydrolysate[J]. Food Technology and Biotechnology, 2010, 48(4): 519-523.
[2]SHEIH I C, WU T K, FANG T J. Antioxidant properties of a new antioxidative peptide from algae protein waste hydrolysate in different oxidation systems[J]. Bioresource Technology, 2009, 100(13): 3419-3425.
[3]TONG L M, SASAKI S, MCCLEMENTS D J, et al. Mechanisms of the antioxidant activity of a high molecular weight fraction of whey[J]. Journal of Agricultural and Food Chemistry, 2000, 48(5): 1473-1478.
[4]GUO Hang, KOUZUMA Y, YONEKURA M. Isolation and properties of antioxidative peptides from water-soluble Royal Jelly protein hydrolysate [J]. Food Science and Technology Research, 2005, 11(2): 222-230.
[5]SUN Hongmei. Evaluation of antioxidant activity of polysaccharides isolated from Camellia sinensis (tea) in exhausting training mice[J]. Journal of Medicinal Plants Research, 2011, 5(5): 791-795.
[6]LIU Binglan, CHIANG Peishiuan. Production of hydrolysate with antioxidative activity and functional properties by enzymatic hydrolysis of defatted Sesame (Sesamum indicum L.)[J]. International Journal of Applied Science and Engineering, 2008, 6(2): 73-83.
[7]DECKER E A, WARNER K, RICHARDS M P, et al. Measuring antioxidant effectiveness in food[J]. Journal of Agricultural and Food Chemistry, 2005, 53(10): 4303-4310.
[8]LIU Jeruei, CHEN Mingju, LIN Chinwen. Antimutagenic and antioxidant properties of milk-kefir and soymilk-kefir[J]. Journal of Agricultural and Food Chemistry, 2005, 53(7): 2467-2474.
[9]YOU Lijun, ZHAO Mouming, CUI Chun, et al. Effect of degree of hydrolysis on the antioxidant activity of loach(Misgurnus anguillicaudatus) protein hydrolysates[J]. Innovative Food Science and Emerging Technologies, 2009, 10(2): 235-240.
[10]WANG Xiansheng, TANG Chuanhe, CHEN Ling, et al. Characterization and antioxidant properties of hemp protein hydrolysates obtained with neutrase[J]. Food Technology and Biotechnology, 2009, 47(4): 428-434.
[11]YI O S, MEYER A S, FRANKED E N. Antioxidant activity of grape extracts in a lecithin liposeme system[J] . Journal of the American Oil Chemists,Society, 1997, 74(10): 130l-1306.
[12]CHEN Huaming, MURAMOTO K, YAMAUCHI F. Structural analysis of antioxidative peptides from soybean β-conglycinin[J]. Journal of Agricultural and Food Chemistry, 1995, 43(3): 574-578.
[13]DORMAN H J D, KO AR M, KAHLOS K, et al. Antioxidant properties and composition of aqueous extracts from Mentha species, hybrids, varieties, and cultivars[J]. Journal of Agricultural and Food Chemistry, 2003, 51(16): 4563-4569.
[14]KIM S Y, JE J Y, KIM S K. Purification and characterization of antioxidant peptide from hoki (Johnius belengerii) frama protein by gastrointestinal digestion[J]. Journal of Nutritional Biochemistry, 2007, 18(1): 31-38.
[15]刘明, 倪辉, 吴永沛. 大豆抗氧化活性肽研究进展[J]. 食品科学, 2006, 27(12): 897-901.
Effects of Different Treatment Conditions on Antioxidant Activity of Peanut Antioxidant Peptide
YU Li-na1,GAO Jun-an2,YANG Qing-li1,*,SUN Jie1,BI jie1,ZHANG Chu-shu1,LIU Shao-fang1
(1. Shandong Peanut Research Institute, Qingdao 266100, China;2. Shandong Shijichun Foodstuff Co. Ltd., Linyi 276400, China)
Peanut antioxidant peptide was prepared by sequential hydrolysis of peanut protein powder with Viscozyme L followed by alcalase. The effects of heat, food additive, preservative, metal ion, sterilization, pH and low temperature treatment on antioxidant properties in vitro such as DPPH radical scavenging activity, reducing power, ferrous ion chelating ability and antilipid peroxidation were investigated. The results indicated that heat treatment and food preservative treatment were beneficial for increasing the antioxidant activity of peanut antioxidant peptide. The addition of tartaric acid or citric acid had considerable impact on the antioxidant activity of peanut antioxidant peptide. Nevertheless, the antioxidant activity remained at a stable level in the presence of sodium chloride or sucrose. Copper ion also had an obvious effect on the antioxidant activity of peanut antioxidant peptide. Various sterilization processes were beneficial to the scavenging of DPPH free radicals, reducing power, ferrous ion chelating capacity, but could reduce the inhibitory rate of lipid peroxidation. The reducing power, ferrous ion chelating capacity and anti-lipid peroxidation could be enhanced under alkaline conditions, whereas acidic conditions could reduce the ferrous ion chelating capacity and anti-lipid peroxidation. Low temperature treatment could reduce the antioxidant activity of peanut antioxidant peptide.
Viscozyme L;Alcalase;peanut antioxidant peptide;different treatment conditions;antioxidant activity
TS201.1;TS229
A
1002-6630(2012)11-0104-07
2011-06-21
“十一五”国家科技支撑计划项目(2008BAD97B04);国家现代农业产业技术体系专项(nycytx-19);青岛市公共领域科技支撑计划项目(09-1-1-84-nsh)
于丽娜(1974—),女,助理研究员,博士,研究方向为花生功能保健食品的开发与应用。E-mail:lhtyln0626@yahoo.com.cn
*通信作者:杨庆利(1977—),男,副研究员,博士,研究方向为花生综合利用。E-mail:rice407@163.com



