于华强,籍保平*,柳 嘉,周 峰,高丰衣,苏春元
(中国农业大学食品科学与营养工程学院,北京 100083)
芹菜素对3T3-L1前脂肪细胞增殖及分化作用研究
于华强,籍保平*,柳 嘉,周 峰,高丰衣,苏春元
(中国农业大学食品科学与营养工程学院,北京 100083)
目的:研究芹菜素(apigenin,AP)对3T3-L1前脂肪细胞增殖及分化的影响。方法:采用3T3-L1前脂肪细胞,利用MTT比色分析法检测不同质量浓度芹菜素对3T3-L1前脂肪细胞增殖的影响;采用传统的鸡尾酒诱导剂诱导分化3T3-L1前脂肪细胞,利用油红O染色检测,通过比色分析法检测不同质量浓度芹菜素对3T3-L1前脂肪细胞分化的影响。结果:30、50μg/mL芹菜素相对于空白组和阳性对照组能够显着抑制3T3-L1前脂肪细胞增殖和分化,提示其可能具有预防肥胖的作用。
芹菜素;3T3-L1;增殖;分化;肥胖
Abstract:Objective: To investigate the effect of apigenin on proliferation and differentiation of 3T3-L1 preadipocytes.Methods: 3T3-L1 preadipocytes were used as target cells to explore the effect of apigenin on their proliferation measured by MTT assay. Besides, cell differentiation using differentiation cocktail, oil red O staining and spectrometric determination were carried out for investigating the effect of apigenin on the differentiation of 3T3-L1 preadipocytes. Results: Apigenin at 30μg/mL and 50μg/mL concentrations could inhibit the proliferation and differentiation of 3T3-L1 preadipocytes in comparison with the blank group and the positive control group (established using Dulbecco s modified Eagle s medium containing 0.5 mmol/L IBXM,1μmol/L dexamethasone and 10μmol/L insulin). Conclusion: Apigenin appear to have potential for the prevention of obesity.
Key words:apigenin;3T3-L1 preadipocytes;proliferation;differentiation;obesity
肥胖主要是由于能量摄入和消耗失衡引起的代谢紊乱综合症,可引起体内脂肪过多的堆积或异常,从而影响整个机体的正常生理功能,增加动脉粥样硬化、冠心病、高血压、糖尿病、肿瘤、高血脂等疾病的发病危险[1-4]。2005年公布的“中国居民营养与健康状况调查”显示,我国儿童肥胖者为8.1%,成人超重和肥胖者分别为20%和10%。与1992年资料相比,成人超重率上升39%,肥胖率上升97%[5]。同时,在西方发达国家,各国在肥胖及并发症的治疗方面投入的经费占卫生总经费的5%~10%,每年高达数千亿美元。因此,开发和利用具有减肥作用的功能食品,对提高肥胖人群的生活质量,保护人体健康具有重要的现实意义。
芹菜素(apigenin,AP) 是天然存在的一种黄酮类化合物,化学结构为4′,5,7 - 三羟黄酮,广泛存在于水果、蔬菜、豆类、茶叶中[6],而芹菜含量最高。体外研究或动物实验显示芹菜素具有多方面的药理作用,例如其具有明显的抗肿瘤作用[7-13]、抗氧化作用[14]、降血压和舒张血管预防动脉粥样硬化作用[15]以及保护中枢神经系统等作用[16]。因此,芹菜素对健康的影响已引起广泛关注,成为营养学及药理学研究的热点。
本实验采用3T3-L1前脂肪细胞,利用MTT比色分析法研究不同质量浓度芹菜素对3T3-L1前脂肪细胞增殖的影响;并进一步采用传统的鸡尾酒诱导剂诱导分化3T3-L1前脂肪细胞,利用油红O染色,通过比色分析法研究不同质量浓度芹菜素对3T3-L1前脂肪细胞分化的影响;从抑制3T3-L1前脂肪细胞增殖和分化两个方面研究芹菜素预防肥胖的作用效果。
1 材料与方法
1.1 材料与试剂
3T3-L1前脂肪细胞 中科院上海细胞所;胎牛血清(FBS)、高糖DMEM培养液 美国Gibco公司;MTT、3-异丁基-1-甲基黄嘌呤(IBMX)、胰岛素(Insulin)、地塞米松(DEX)、胰蛋白酶 美国Sigma公司;油红O染料 上海化学试剂厂;青霉素-链霉素溶液(100×) 碧云天生物技术研究所。
1.2 仪器与设备
XDOS-1B倒置生物显微镜 重庆光电有限公司;SW-CJ-2FD双人单面净化工作台 苏州净化设备有限公司;MCO-15ACCO2培养箱(37℃) 日本Sanyo公司;TDL-40B台式离心机 上海安亭科学仪器厂;Multiscan MK3自动酶标分析仪 美国Thermo公司;DHG-9075A电热恒温鼓风干燥箱 上海一恒科技有限公司。
1.3 试剂的配制
MTT溶液:称取50mg MTT溶于PBS溶液中配制成5mg/mL MTT溶液,过滤后4℃避光保存两周内有效,避免反复冻融,最好小剂量分装,避光保存。
胰岛素溶液:最终培养基中胰岛素的质量浓度为10μg/mL。酸化水的配制:4.9mL的注射用水加0.lmL的浓盐酸混合备用。工作液的配制:称取胰岛素2.5mg溶于1mL酸化水中,得到胰岛素2.5mg/mL的工作液,分装-20℃保存备用。避免反复冻融。
地塞米松溶液:最终培养基中地塞米松的浓度为1μmol/L。工作液的配制:称取地塞米松溶于无水乙醇溶液,终质量浓度为5mg/mL (12700μmol/L),取上述溶液10μL加入990μL注射用水得到地塞米松0.05mg/mL(127μmol/L)的工作液,4℃保存备用。
IBMX:最终培养基中IBMX的浓度为0.5mmol/L。工作液的配制:称取IBMX 5mg,溶于100μL DMSO得到IBMX 0.225mol/L的工作液,-20℃保存备用。
诱导剂Ι:用DMEM完全培养基配制终浓度为0.5mmol/L IBMX、1μmol/L地塞米松和10μg/mL胰岛素的诱导剂。
诱导剂Ⅱ:用DMEM完全培养基配制终质量浓度为10μg/mL胰岛素的诱导剂。
油红O染料:称取0.25g油红O加入100mL异丙醇,50℃加热助溶lh,冷却后,过滤作为储存液,使用时,取6份上述储存液加4份双蒸水混匀,静置10min,即为使用液。
由表11中的各分析参数可知,F=840.7143远远大于Fcrit=5.192168,故由此证明不同调和比例油样之间在该方法下凝点检测结果差异显着。P-value=2.97E-07,远远小于α=0.05,表明在置信度为95%时该结果可信。该方法能够区分凝点不同的柴油。
1.4 3T3-L1前脂肪细胞的培养
将3T3-L1前脂肪细胞置于含10%胎牛血清的DMEM高糖培养基(25mmol/L)中,37℃、5%CO2饱和湿度,1%双抗条件培养,长满80%时传代。
1.5 3T3-L1前脂肪细胞的密度与MTT光密度值的对应关系
将3T3-L1前脂肪细胞置于含10%胎牛血清的DMEM高糖培养基中,37℃、5%CO2饱和湿度,1%双抗条件下培养。显微镜下观察细胞已贴壁,呈梭形、透亮,换培养液,生长至接触抑制时细胞用胰酶消化,吹打成单个细胞,计数,然后将细胞密度分别调整至1×l06、5×l05、1×l05、5×l04、1×l04、5×l03个/mL接种至96孔板,每个密度6个复孔,12h细胞贴壁后采用MTT法测定其光密度值,以得到3T3-L1前脂肪细胞细胞密度与MTT光密度值的对应关系。
1.6 细胞增殖活力检测
活细胞线粒体中有与NADP相关的脱氢酶,可将黄色的四甲基偶氮唑蓝(MTT)还原为不溶性的蓝紫色结晶,用DMSO将蓝紫色结晶溶解后,在550nm波长处用酶标仪检测光密度值。
3T3-L1前脂肪细胞接种于96孔板,调整每孔细胞密度为5×103个/mL。常规培养12h,换以用DMEM培养液配制的芹菜素溶液200μL,芹菜素质量浓度分别为5、10、30、50、100μg/mL,阳性对照为3.4μg/mL罗格列酮,同时设空白对照组。每个实验组设12个平行孔,连续培养2d。在此期间,分别在24h和48h时,于芹菜素各剂量组中分别选取6个平行孔加入20μL新鲜配制的5mg/mL的MTT培养液培养4h。将培养液吸干后,每孔加入200μL DMSO,轻轻振荡10min溶解紫色结晶。酶标仪550nm波长处测定光密度值,观察芹菜素对3T3-L1前脂肪细胞增殖的影响。
1.7 3T3-Ll前脂肪细胞株的诱导分化
将3T3-Ll前脂肪细胞接种于96孔培养板,使每孔细胞密度为5×104个/mL。用含10%胎牛血清的高糖DMEM培养基在37℃、5%CO2培养,待细胞融合2d后,设一组空白对照组,正常加入诱导剂Ι;一组阳性对照组加入由诱导剂Ι配制的3.4μg/mL罗格列酮;各实验浓度组加入由诱导剂Ι配制的质量浓度分别为5、10、30、50、100μg/mL的芹菜素,培养48h;换以用诱导剂Ⅱ配制的各组溶液,再培养48h,随后以含10%胎牛血清的高糖DMEM培养基继续培养,每2d换培养液一次[17]。
1.8 3T3-L1前脂肪细胞油红O染色
油红O是目前被认为最优良的脂肪染色染料,为脂溶性,在脂肪内能高度溶解,从而染色,并能保存组织细胞中的脂肪滴。
不同组的3T3-L1前脂肪细胞,用PBS洗3次,10%多聚甲醛固定细胞30min,PBS洗净后将细胞晾干30 min,加入油红O染液于细胞表面,静置60min后用60%异丙醇洗细胞2次去除多余的染料。再以双蒸水洗3~4次后。倒置显微镜下观察结果,拍摄照片[18]。
1.9 3T3-Ll前脂肪细胞诱导分化过程中脂肪积聚的定量检测
成熟的脂肪细胞含有脂肪滴,这些脂肪滴可被脂溶性的油红O染料染成橘黄色或红色。用异丙醇溶解脂肪细胞中的油红O染料后,在550nm波长处用酶标仪检测光密度值,可以定量检测细胞内脂肪的含量,判断脂肪细胞的分化程度。
已经完成油红O染色的细胞,加异丙醇溶解油红O,振荡摇匀5min,用酶标仪在550nm的波长处测定各孔的光密度值[19]。
1.10 统计学处理
数据结果采用SPSS12.0软件进行One-Way ANOVA分析,邓肯氏多重检验用来确定数据间的显着性差异,显着水平设定为P<0.05。
2 结果与分析
2.1 3T3-L1前脂肪细胞的密度与MTT光密度值的对应关系
MTT光密度值可以间接反映活细胞密度,由于3T3-L1前脂肪细胞生长曲线根据MTT光密度值制得,因此实验分别采用不同密度细胞测定其MTT光密度值得到对应关系如表1所示。
2.2 3T3-L1前脂肪细胞生长曲线
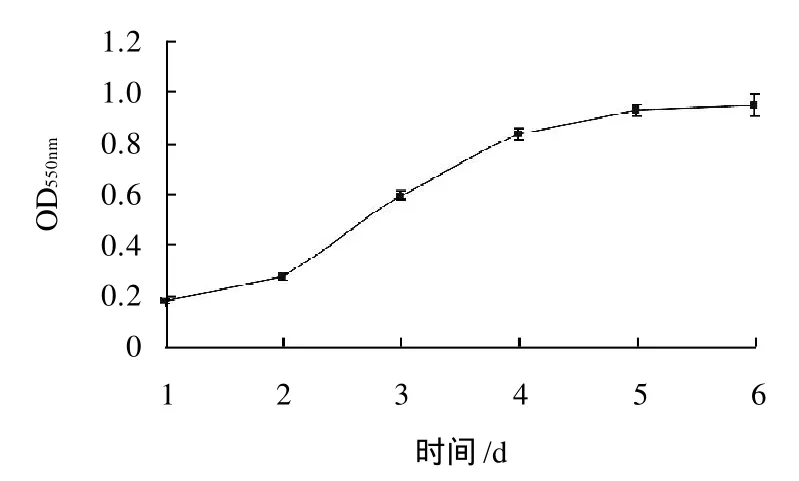
图1 3T3-L1前脂肪细胞生长曲线Fig.1 Cell growth curve of 3T3-L1 preadipocytes
由图1可知,3T3-Ll前脂肪细胞以1×103个/mL开始培养,从第2天开始细胞开始快速增殖,至第4天增殖速度显着降低,其中第2天开始快速增殖时细胞密度约为5×103个/mL,第2天到第4天为细胞对数增长期,因此评价不同质量浓度芹菜素对3T3-Ll前脂肪细胞增殖活力的影响时,细胞接板密度确定为5×103个/mL,培养时间确定为48h。
2.3 芹菜素对3T3-Ll前脂肪细胞增殖活力的影响
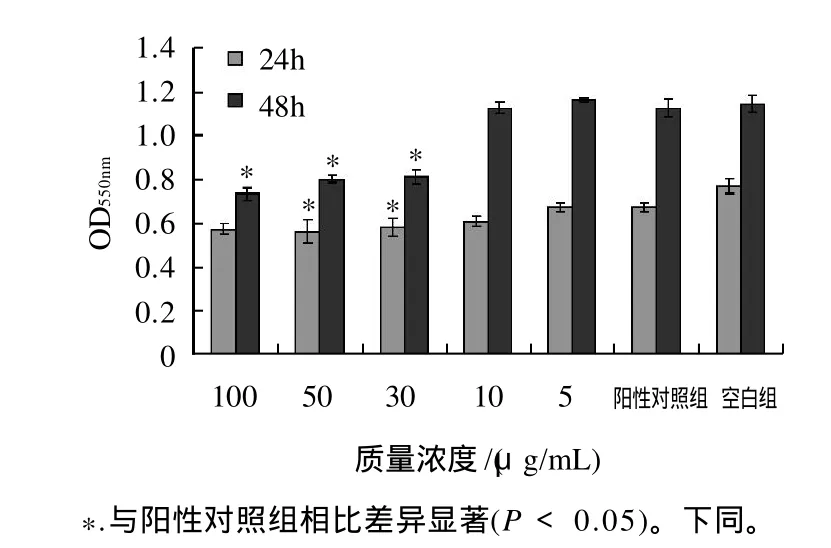
图2 不同质量浓度芹菜素对前脂肪细胞增殖的影响Fig.2 Effect of different concentrations of apigenin on the proliferation of 3T3-L1 preadipocytes
MTT是一种能够接收氢原子的化学染料,活细胞线粒体中的琥珀酸脱氢酶能使外源性的MTT还原为难溶解的蓝紫色结晶并沉积在细胞中,而死细胞无此功能。在一定细胞数量范围内,蓝紫色结晶的形成量与细胞数量成正比,因而光密度值可以间接反映活细胞数量。由图2可知,芹菜素对3T3-L1前脂肪细胞有明显生长抑制作用,随着其质量浓度的增加,其抑制细胞生长的作用逐渐加强。24h后,阳性对照组及各质量浓度实验组OD值相对于空白组明显降低,其中30、50μg/mL质量浓度实验组细胞增殖分别比空白组低16.18%、17.64%,与阳性对照组相比具有显着差异。48h后,阳性对照组及5、10μg/mL实验组相对于空白组抑制增殖效果不明显。30μg/mL质量浓度以上实验组抑制作用明显提高,相对于阳性对照组差异显着。
2.4 芹菜素对3T3-Ll前脂肪细胞分化的影响
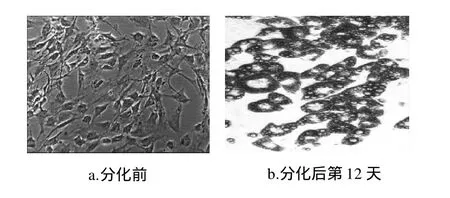
图3 分化前脂肪细胞与分化后脂肪细胞Fig.3 Morphological mirographs of 3T3-L1 preadipocytes and adipocytes

表1 3T3-L1前脂肪细胞密度与MTT光密度值对应关系Table 1 Density of 3T3-L1 preadipocytes versus optical density in MTT assay
由图3可知,诱导分化前的3T3-L1脂肪细胞呈典型的梭形,胞浆中无脂滴,形态与成纤维细胞相似。当细胞完全融合后,处于生长停滞,未见处于明显分裂相的细胞,诱导分化第4天时,细胞变大、变圆,细胞中有脂滴出现。诱导分化第12天时,前脂肪细胞分化为成熟的脂肪细胞,表现为细胞胞浆丰富,含有大量的脂滴,脂滴分布于核周围,形成“戒指环”结构,为典型的成熟脂肪细胞形态。
前脂肪细胞为纤维细胞,分化成熟的脂肪细胞形态为近圆形和圆形。二者最重要的区别是分化成熟的脂肪细胞能够合成甘油三酯,进行脂质贮存。细胞质中出现多个小脂滴或者单独一个大脂滴,将胞核挤在旁边。油红O可以与脂滴结合呈红色,因此油红O染色可以直观反应脂肪细胞的分化程度。
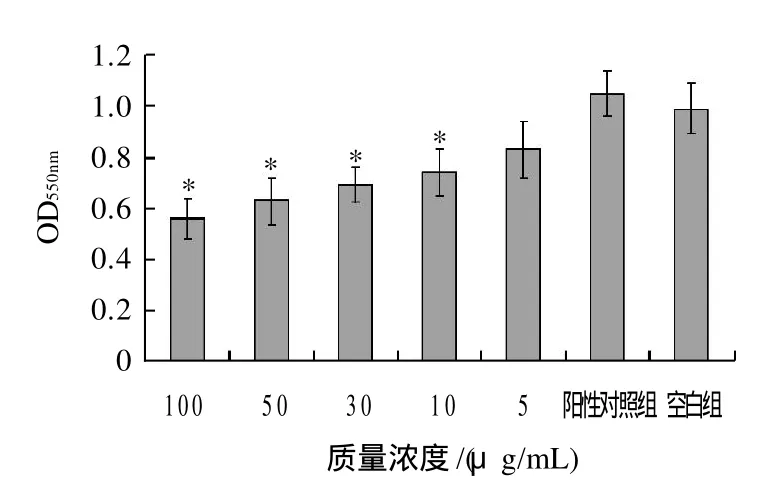
图4 不同质量浓度芹菜素对脂肪细胞分化的影响(油红O染色)Fig.4 Effect of different concentrations of apigenin on the differentiation of 3T3-L1 preadipocytes (oil red O staining)
由图4可知,经不同质量浓度芹菜素干预后,各组细胞分化不同程度被抑制。随着芹菜素质量浓度的升高抑制作用逐渐加强,相对于空白组,芹菜素组:10μg/mL组细胞分化降低37.29%,30μg/mL组降低41.52%,50μg/mL组降低46.61%,100μg/mL组降低52.54%。质量浓度大于10μg/mL实验组相对于阳性对照组分化程度显着降低,差异显着,提示芹菜素具有抑制脂肪细胞分化的作用。
3 讨 论
3T3-L1细胞属小鼠源的成纤维细胞系,是前脂肪细胞,经特殊的诱导分化剂作用后,可以分化为成熟的脂肪细胞。包括在形态学改变、细胞生长、多种脂肪代谢酶的表达、脂质积累等方面能充分展示体脂肪细胞的特点,是目前国内外进行脂肪细胞功能及糖脂代谢研究中使用最广泛的细胞株之一[20-21]。抗肥胖主要原理为提高能量消耗,增加脂肪分解和氧化,减少能量摄入,减少前脂肪细胞分化和增殖,减少脂肪细胞脂肪合成。前脂肪细胞可转化成为成熟脂肪细胞,因此抑制前脂肪细胞增殖和分化是抗肥胖的一个重要方法。
芹菜素作为一种天然存在的黄酮类化合物,其对肿瘤的化学预防作用及其机制已得到较为深入的研究,而近年来芹菜素的其他药理药效也得到日益广泛的关注和研究。通过本实验显示芹菜素具有抑制3T3-L1前脂肪细胞增殖和分化的作用,提示其可能具有预防肥胖的作用。然而,芹菜素药理学作用的研究大多尚处于体外实验和动物模型阶段,许多作用机制仍不清楚,对芹菜素的研究还需进一步深入。
[1] HUBERT H B. The importance of obesity in the development of coronary risk factors and disease: the epidemiological evidence[J]. Annu Rev Public Health, 1986(7): 493-502.
[2] 陈光亮. 盐酸西布曲明对营养性肥胖大鼠的减肥作用[J]. 中国临床药理学与治疗学, 2003, 8(1): 56-59.
[3] DANIEL E, ROSENBERG S. Insulin resistance, diabetes and cardiovascular risk: approaches to treatment[J]. Diabetes Obesity and Metabolism, 2005, 7(6): 642-653.
[4] van ITALLIE T B. Health implications of over weight and obesity in the United States[J]. Am Int Med, 1985, 103: 983-984.
[5] 郑荣梁, 黄中洋. 自由基生物学[M]. 北京: 高等教育出版社, 2007: 249.
[6] BLOCK G, PATTERSON B, SUBAR A. Fruit, vegetable and cancer prevention: a review of epidemiological evidence[J]. Nutr Cancer, 1992(18): 10-29.
[7] TAKAGAKI N, SOWA Y, OKI T, et al. Apigenin induces cell cycle arrest and p21/WAF1 expression in a p53-independent pathway[J]. Int J Oncol, 2005, 26 (1): 185-189.
[8] ZHENG P W, CHANG C, LIN C C. Apigenin induced apoptosis through p53-dependent pathway in human cervical carcinoma cells[J].Life Sci, 2005, 76 (12): 1367-1379.
[9] FANG Jing, XIA Chang, CAO Zongxian, et al. Apigenin inhibits VEGF and HIF-1 expression via PI3K/AKT/p70S6K1 and HDM2/p53 pathways[J]. FASEB J, 2005, 19 (3): 342-353.
[10] 屈朝法, 马礼坤. Bcl-2 家族与心肌细胞凋亡的研究进展[J]. 国际病理科学与临床杂志, 2005, 25(4): 291-293.
[11] BEKTIC J, GUGGENBERGER R, SPENGLER B, et al. The flavonoid apigenin inhibits the proliferation of prostatic stromal cells via the MAPK-pathway and cell-cycle arrest in G1/S[J]. Maturitas, 2006,55: S37-S46.
[12] 胡太平, 曹建国. 芹菜素诱导人胃癌细胞凋亡作用及机制研究[J]. 国际病理科学与临床杂志, 2007, 27(1): 6-10.
[13] 金雪瑛, 任常山. 芹菜素抑制人乳腺癌MDA-MB-231细胞血管内皮生长因子表达[J]. 中国现代医学杂志, 2007, 17(4): 402-409.
[14] KANG S S, LEE J K, CHOI Y K. Neuropmtective effects of flavones on hydrogen peroxide-induced apoptosis in SHSY5Y neuroblastoma cells[J]. Bioorg Med Chem Lett, 2004, 14(9): 2261-2264.
[15] ZHANG Yonghe, PARK Y S, KIM T J, et al. Endothelium-dependent vasorelaxant and antiproliferative effects of apigenin[J]. Gen Pharmacol,2000, 35 (6): 341-347.
[16] 赵宇红, 陈伟强, 罗少洪, 等. 芹黄素对老年痴呆小鼠学习记忆能力的影响[J]. 广东医学院学报, 2005, 21(3): 292-294.
[17] KIM M Y, IWAI K, ONODERA A, et al. Identification and antiradical properties of anthocyanins in fruits of Viburnum dilatatum thunb[J]. J Agric Food Chem, 2003, 51(21): 6173-6177.
[18] MADERA H, HOSOKAWA M, SASHIMA T, et al. Fucoxanthin and its metabolite, fucoxanthinol, suppress adipocytes differentiation in 3T3-L1 cells[J]. J Mol Med, 2006, 18(1): 147-152.
[19] DALLAS C, GERBI A, TENCA G, et al. Lipolytic effect of a polyphenolic citrus dry extract of red orange, grapefruit, orange(SINETROL) in human body fat adipocytes: Mechanism of action by inhibition of cAMP-phospho- diesterase(PDE)[J]. Phytomedicine, 2008(15): 783-792.
[20] COOKE D W, PATEL Y M. GLUT4 expression in 3T3-Ll adipocytes is repressed by porteasome inhibition, but not by inhibition of calpains[J]. Mol Cell Endocrinol, 2005, 232: 37-45.
[21] HAUGEN F, ZAHID N, DALEN K T, et al. Resistin expression in 3T3-Ll adipocytes is reduced by arachidonic acid[J]. J Lipid Res, 2005,46: 143-153.
Effect of Apigenin on the Proliferation and Differentiation of 3T3-L1 Preadipocytes
YU Hua-qiang,JI Bao-ping*,LIU Jia,ZHOU Feng,GAO Feng-yi,SU Chun-yuan
(College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China)
Q946.8
A
1002-6630(2010)15-0260-04
2010-02-01
于华强(1982—),男,硕士研究生,研究方向为食品科学。E-mail:yhqiang2012@yahoo.com.cn
*通信作者:籍保平(1958—),男,教授,硕士,研究方向为果蔬加工与功能食品。E-mail:jbping@cau.edu.cn



