王运改,林 琳,李明辉,翁世兵,叶应旺,姜绍通,陆剑锋*
(合肥工业大学生物与食品工程学院,安徽 合肥 230009)
鮰鱼皮明胶抗氧化肽的制备工艺研究
王运改,林 琳,李明辉,翁世兵,叶应旺,姜绍通,陆剑锋*
(合肥工业大学生物与食品工程学院,安徽 合肥 230009)
通过测定鮰鱼皮明胶蛋白酶解物对Fenton体系产生的羟自由基的清除效果,筛选得出胰蛋白酶和胃蛋白酶酶解物具有较高的清除羟自由基(·OH)的活性;用正交试验L9(34)对胰蛋白酶的水解条件进行优化,确定最佳的水解条件为温度40℃、pH7.5、酶与底物质量浓度比(E/S)3.5%、底物质量浓度2.5g/100mL、酶解时间3h。此外,本研究还采用胰蛋白酶和胃蛋白酶进行了复合酶解试验,确定复合酶解的最佳水解条件为先用胰蛋白酶酶解3h,然后用胃蛋白酶酶解3h,此时得到的酶解液自由基清除率最高,达到47.38%。
鮰鱼;酶解;活性肽;羟自由基
明胶广泛应用于工业领域,如食品工业、材料工业、制药工业等。研究表明,明胶多肽具有多方面的生理功能[1],如:蛋白质消化吸收率几乎达到100%;保护胃黏膜以及抗溃疡作用;抑制血压上升作用;促进骨形成作用;促进皮肤代谢(美容效果);胶原多肽还对关节炎等胶原病具有很好的预防及治疗作用。
长期以来,人们都是使用猪、牛的皮和骨提取胶原蛋白和明胶。但随着疯牛病(BSE)、口蹄疫(FMD)等牲畜疾病的爆发,使人们对牲畜胶原制品安全性产生疑虑[2]。另外,由于宗教和习俗等原因,有些地区也不能使用牲畜胶原蛋白制品,因此寻找猪、牛皮和骨以外的明胶原料制备明胶和相关制品成为当务之急,而水产加工废弃物(如鱼皮、鱼骨和鱼鳞等)就成为最理想和现实的替代原料[3]。随着世界各国水产加工业的发展,产生越来越多的水产废弃物,结合研究的不断深入,目前人们已经能从鱼皮、鱼骨和鱼鳞等废弃物中提取明胶加以利用,这不仅可以促进水产加工废弃物的综合利用、提高产值,而且还可以减少对环境的污染。
自由基是一类具有高度活性的物质,可以在细胞代谢过程中不断地产生,它可直接或间接地发挥强氧化作用,广泛地参与机体的生理与病理过程[4]。生物体内最有害的自由基为羟自由基,可以对活细胞内的生物分子造成极大的危害[5]。本研究采用生物技术手段对斑点叉尾鮰(Ictalurus punctatus)鱼皮明胶进行酶解,得到具有清除羟自由基作用的蛋白质水解物,该水解物可以作为具有抗衰老活性的功能性食品和化妆品进行开发利用,并为进一步的工业化生产提供实验依据。
1 材料与方法
1.1 材料与试剂
鮰鱼皮由安徽省明光市永言水产(集团)有限公司提供,清洗后于-20℃冷藏。
胃蛋白酶(≥1200U/g)、胰蛋白酶(≥1200U/g) 国药集团化学试剂有限公司;木瓜蛋白酶(80万U/g生物酶制剂)、碱性蛋白酶(≥5万U/g)、中性蛋白酶(20万U/g)南宁庞博生物工程有限公司;其他试剂均为分析纯。
1.2 仪器与设备
721分光光度计 上海第三分析仪器厂;CT15RT高速冷冻离心机 上海天美生化仪器设备有限公司;JJ-1型定时电动搅拌器 江苏金坛市金城国盛实验仪器厂;旋涡混合器 Barloworld Scientific公司;PHS-3C精密pH计 上海大普仪器有限公司;电子分析天平 上海民桥精密科学仪器有限公司;HH-2孔数显水浴锅 江苏金坛环宇科学仪器厂。
1.3 方法
1.3.1 鮰鱼皮基本成分的测定
水分含量测定:直接干燥法,参照GB/T 5009.3—2003《食品中水分的测定》;灰分测定:灼烧称质量法,参照GB/T5009.4—2003《食品中灰分的测定》;粗蛋白测定:凯氏定氮法,参照GB/T 5009.5—2003《食品中蛋白质的测定》;粗脂肪测定:索氏抽提法,参照GB/T 5009.6—2003《食品中脂肪的测定》;胶原蛋白含量测定:通过测定羟脯氨酸含量换算鮰鱼皮中的胶原蛋白含量[6-7]。
羟脯氨酸含量测定:称量约5mg鱼皮(干基)置于安瓿瓶中,加入1mL 6mol/L的HCl,在酒精喷灯上封管,放入130℃的电热鼓风干燥箱中,水解3h,水解后的液体经稀释,移入250mL容量瓶中定容。吸取上述稀释液4mL于具塞试管中,加入氯胺T溶液2mL,摇匀后于室温放置氧化20min,加入10g/100mL对二甲基氨基苯甲醛2mL,摇匀,塞上塞子于60℃恒温水浴中保温20min,保温后迅速用流动的冷水冷却至室温,在波长(558±2)nm处测定吸光度,记录数值。由羟脯氨酸标准曲线得到相应吸光度的羟脯氨酸含量,则胶原蛋白含量按下列公式计算:

1.3.2 鮰鱼皮明胶的提取
称取一定量的鱼皮,剪成小块,按料液比1:6的比例用体积分数10%正丁醇浸泡1d(脱脂),然后加0.05mol/L NaOH溶液(料液比为1:6)浸泡30min,水洗至中性,再加质量分数0.2%硫酸溶液(料液比为1:6)浸泡30min,水洗至中性,最后用热水抽提过夜,4000r/min离心20min,弃去沉淀不溶物,得到粗胶制品,于冷冻干燥机中冻干[8]。
1.3.3 鮰鱼皮明胶水解工艺
称取制备的明胶,用100mL(相应pH值)磷酸盐缓冲液溶解制成相应浓度的明胶溶液,以此为底物。按照试验设计调节恒温水浴锅至所需温度,按水解所需加酸(HCl)或碱(NaOH)达到预定的pH值,加入一定量的酶进行水解,水解时间为所设时间。水解过程中用电动搅拌机不断搅拌,水解达到预定时间后,沸水浴中灭酶活10min,终止水解反应,然后迅速冷却至室温,置于离心机中,以4000r/min离心15min,倾倒出上清液,取上清液2mL稀释到50mL,然后测定其水解度和清除羟自由基的活性。
1.3.4 水解度测定
采用茚三酮方法[9]。
1.3.5 水解物对羟自由基(·OH)清除能力的测定[10]
向试管中加入样品溶液1.00mL 1.8mmol/L FeSO4溶液2.00mL,1.8mmol/L水杨酸-乙醇 1.50mL,最后加体积分数0.03% H2O2溶液 0.10mL启动反应,振荡混合,水浴37℃保温30min,以蒸馏水调零在波长为510nm处测量各自的吸光度。自由基清除率(D)计算公式为:
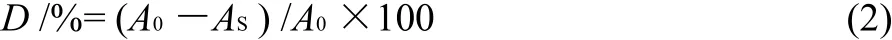
式中:A0为以蒸馏水代替样品液的吸光度;AS为加入样品液后的吸光度。
1.4 工艺优化
分别选用5种蛋白酶(胃蛋白酶、胰蛋白酶、中性蛋白酶、碱性蛋白酶、木瓜蛋白酶),对鱼皮明胶进行水解,测定水解物的羟自由基清除活性,选取水解作用较强的酶,对其水解条件进行优化,确定制备具有较高羟自由基清除活性的水解物的最佳水解工艺条件。然后选取清除羟自由基活性较高的两种酶进行复合水解,确定复合水解的最佳工艺条件。表1所示为5种酶酶解的最适条件。
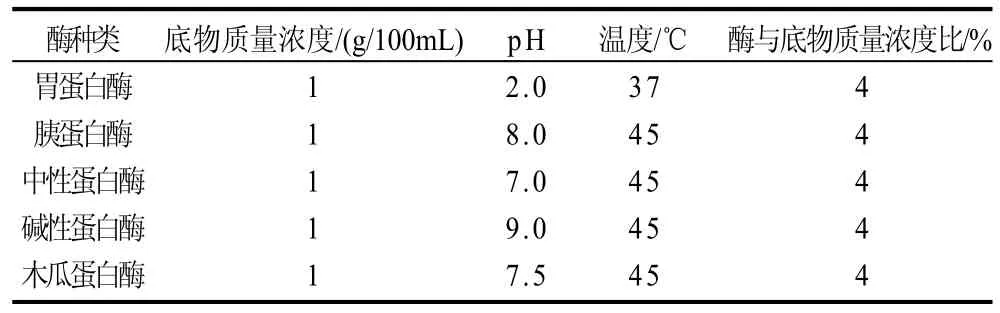
表1 5种酶的酶解条件Table 1 Optimal reaction conditions of five enzymes
2 结果与分析
2.1 鮰鱼皮基本成分

表2 鮰鱼皮的基本成分Table 2 Basic chemical composition of channel catfish skin
由表2可知,干鮰鱼皮中的主要成分为蛋白质,经测定和计算可知,干鮰鱼皮中的胶原蛋白含量为55.32%,占总蛋白质含量的61.93%,所以胶原蛋白是鱼皮中主要蛋白质。此结果表明鮰鱼皮可以作为一种很好的提取明胶的原料。鮰鱼皮中脂肪含量较高,达到8.83%,所以在提取明胶时采用10%正丁醇按照料液比1:6的比例浸泡1d以去除大部分脂肪。
2.2 水解用酶的筛选
选用5种蛋白酶(胃蛋白酶、胰蛋白酶、中性蛋白酶、碱性蛋白酶、木瓜蛋白酶)在其酶活力最高的条件下对鮰鱼皮明胶水解4h(表2),测定水解物的羟自由基清除率,实验结果见图1。
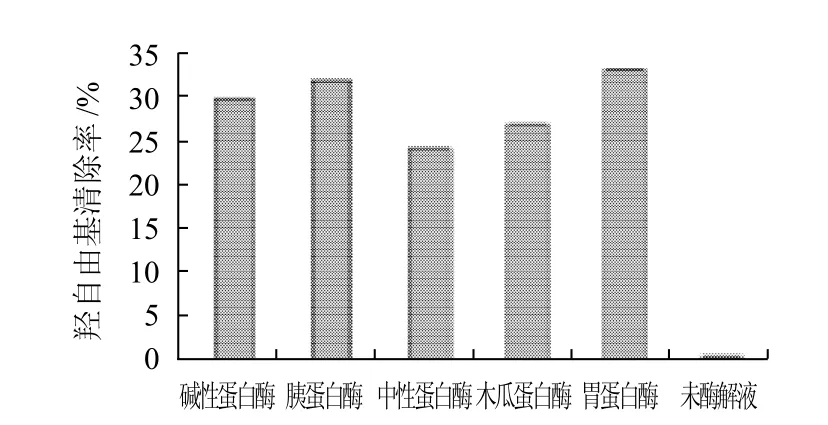
图1 不同蛋白酶水解鱼皮明胶得到的水解液清除羟自由基活性的比较Fig.1 Comparison of hydroxyl free radical scavenging activity of hydrolyzed channel catfish skin gelatin with different enzymes
由图1可知,经过蛋白酶的水解作用,鮰鱼皮明胶水解液的清除羟自由基的能力均显着的提高。从这5种酶的清除羟自由基效果看,胃蛋白酶和胰蛋白酶作用后的水解液对羟自由基的清除能力提高最大,因此选择这两种酶作为酶解鮰鱼皮明胶蛋白用酶。
2.3 胰蛋白酶酶解工艺条件优化
2.3.1 酶解时间的确定
在不同水解时间(1、2、3、4、5、6h)内水解鮰鱼皮明胶,并测定其水解液清除羟自由基的能力大小。由图2可知,随着水解时间的延长,水解液清除羟自由基的能力不断增强。在最初1h内水解液对羟自由基清除能力的增加幅度较大,1h为19.1%;当水解时间达到3h左右,水解液清除羟自由基的能力由2h时的24.15%上升到31.78%,达到最高;继续延长水解时间,水解物的羟自由基清除率基本无显着提高,因此从生产角度考虑,3h是制备具有羟自由清除活性多肽的较适水解时间。
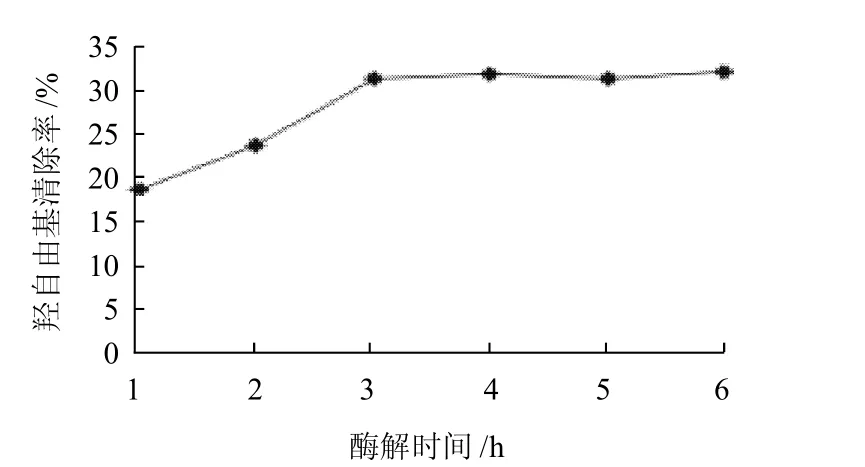
图2 酶解时间对羟自由基清除率的影响Fig.2 Effect of hydrolysis duration on the hydroxyl free radical scavenging rate of hydrolyzed channel catfish skin gelatin
2.3.2 酶解pH值的确定
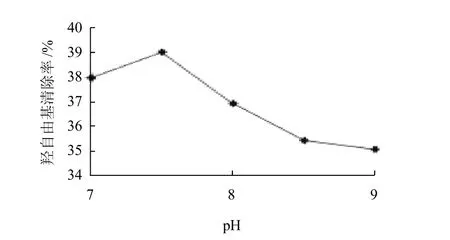
图3 酶解pH值对羟自由基清除率的影响Fig.3 Effect of hydrolysis pH on the hydroxyl free radical scavenging rate of hydrolyzed channel catfish skin gelatin
由图3可知,在水解温度为45℃、酶与底物质量浓度比为4%、底物质量浓度为1g/100mL、酶解时间为3h的条件下,分别在pH7、7.5、8、8.5、9时酶解,清除率分别为38.04%、39.1%、36.99%、35.47%、35.12%。pH值为7.5时,清除率达到最大。
2.3.3 酶解温度的确定

图4 酶解温度对羟自由基清除率的影响Fig.4 Effect of hydrolysis temperature on the hydroxyl free radical scavenging rate of hydrolyzed channel catfish skin gelatin
由图4可知,在酶与底物质量浓度比为4%、pH值为7.5、底物质量浓度为1g/100mL,酶解时间为3h条件下,分别在35、40、45、50、55℃时酶解,清除率分别为22.79%、27.19%、27.8%、26.35%、23.61%。清除率随着温度的升高而增大,在45℃左右,清除率最高,随后又随着温度的上升而下降。在较低温度下,酶作用微弱,温度升高催化能力加大,超过最适温度后反应速度下降,并伴随温度升高酶逐渐变性,清除率下降[11]。
2.3.4 酶与底物质量浓度比的确定
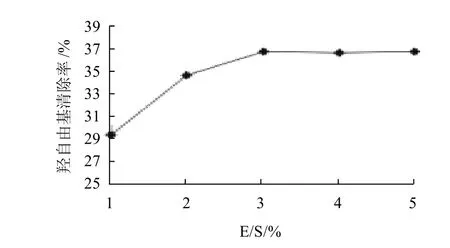
图5 酶与底物质量浓度比对羟自由基清除率的影响Fig.5 Effect of enzyme/substrate ratio on the hydroxyl free radical scavenging rate of hydrolyzed channel catfish skin gelatin
由图5可知,在pH7.5、温度为45℃、底物质量浓度为1g/100mL,酶解3h的条件下,分别在酶与底物质量浓度比(E/S)为1%、2%、3%、4%时酶解,清除率分别为29.4%、34.8%、36.87%、36.73%、36.91%。随着酶与底物质量浓度比的增加,羟自由基清除率逐渐增加,酶与底物质量浓度比增加到一定程度时,清除率不再增加,其可能原因是随着酶质量浓度增加到一定程度,底物达到饱和,酶促反应速度不再增加。所以从实验成本方面考虑,选取3%为最佳的酶与底物质量浓度比,即酶与底物质量浓度比为3%进行水解反应,制备具有清除羟自由基能力的活性多肽。
2.3.5 底物质量浓度的确定
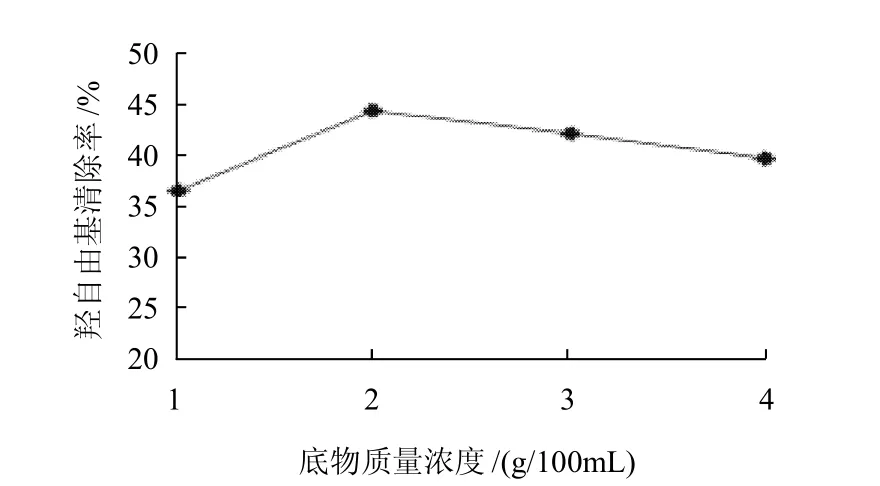
图6 底物质量浓度对羟自由基清除率的影响Fig.6 Effect of substrate concentration on the hydroxyl free radical scavenging rate of hydrolyzed channel catfish skin gelatin
由图6可知,在酶与底物质量浓度比为3%、温度为45℃、pH值为7.5,酶解时间为3h时,分别在底物质量浓度为1、2、3、4g/100mL时酶解,清除率分别为36.87%、44.69%、42.55%、40.06%。随着底物质量浓度的增加,清除率逐渐升高,底物质量浓度为2g/100mL时清除率最高,随着底物质量浓度的继续升高,清除率反而出现下降,其可能原因是随着体系中的水分减少,影响了酶促反应的进行,所以底物质量浓度选择2g/100mL为宜。
2.3.6 最佳水解条件的确定
在上述单因素试验的基础上,综合考虑各因素作用,以温度、pH、底物质量浓度、酶与底物浓度比为主要因素,以羟自由基清除率为指标,采用正交设计确定最佳反应条件。正交试验因素水平见表3,试验结果及方差分析见表4。
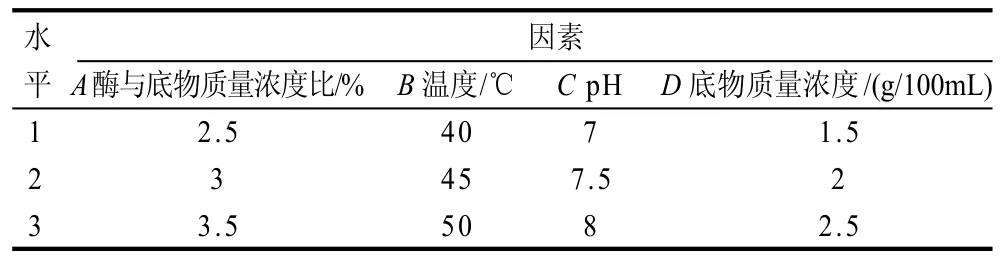
表3 胰蛋白酶的正交试验因素与水平Table 3 Factors and levels in the orthogonal array design L9(34)
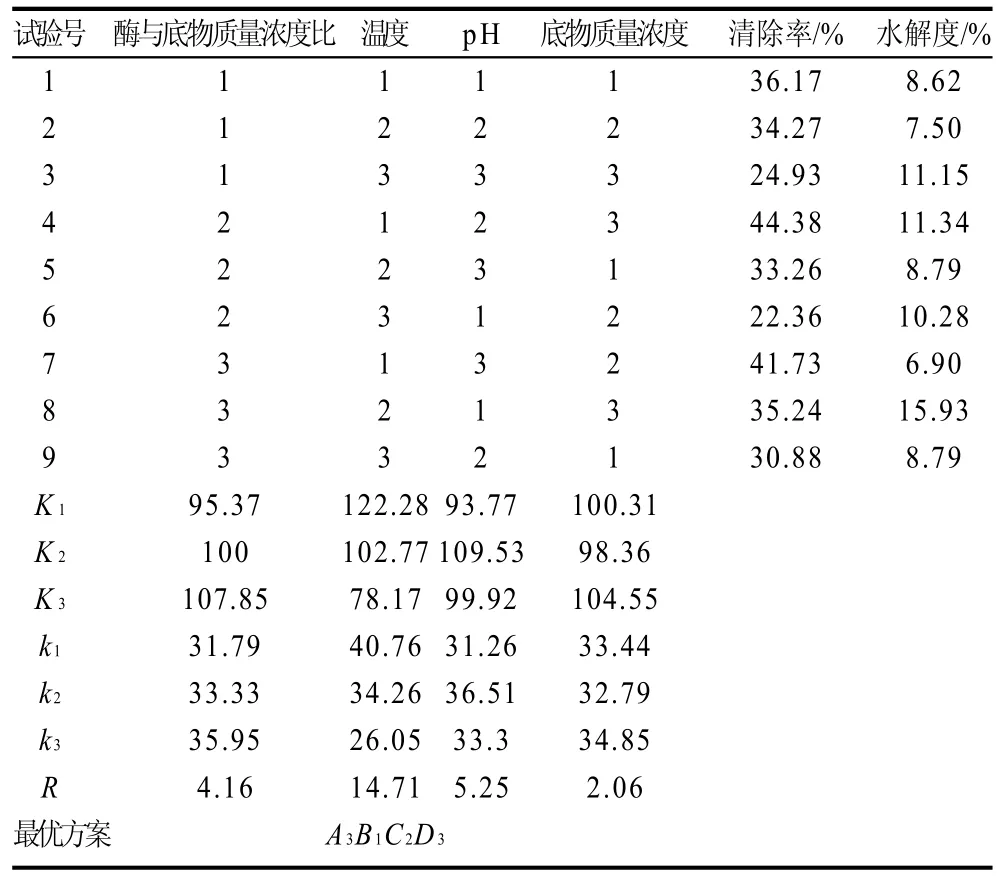
表4 正交试验因素及水平Table 4 Orthogonal array design matrix and experimental results
由表4可知,以水解液对对羟自由基的清除率为评价指标,对正交试验结果进行极差分析,极差由大到小的顺序是B>C>A>D,即温度对清除率的影响最大,pH值次之,其次分别是加酶量和底物质量浓度。根据正交试验结果分析,鮰鱼皮胶原蛋白酶解物清除羟自由基的最佳条件为A3B1C2D3,即确定鮰鱼皮胶原蛋白酶解物清除羟自由基的最佳条件为酶与底物质量浓度比为3.5%、温度40℃、pH7.5、底物质量浓度为2.5g/100mL。同时,对各组正交试验所得水解物的水解度进行测定。水解液的羟自由基清除率和水解度没有相关性,水解度高时,水解物的自由基清除率并不一定高。
2.4 复合酶解条件的确定
由于蛋白酶对肽键作用具有一定的专一性,采用单酶水解时,只能从几个固定的氨基酸残基进行水解,水解程度受到限制,为了得到更小分子质量的水解产物,采用组合酶解是一种必然的趋势。组合酶解切断肽键的位置不同,所以用两种或者两种以上的酶组合制备水解液,有可能进一步降低产物的分子质量,得到分子质量合理分布的水解液[12]。选取两种能够制备高清除羟自由基活性的酶A(胰蛋白酶)和B(胃蛋白酶),进行复合酶解实验,分6组进行实验,各组的具体实验条件见表5,实验结果见图7。
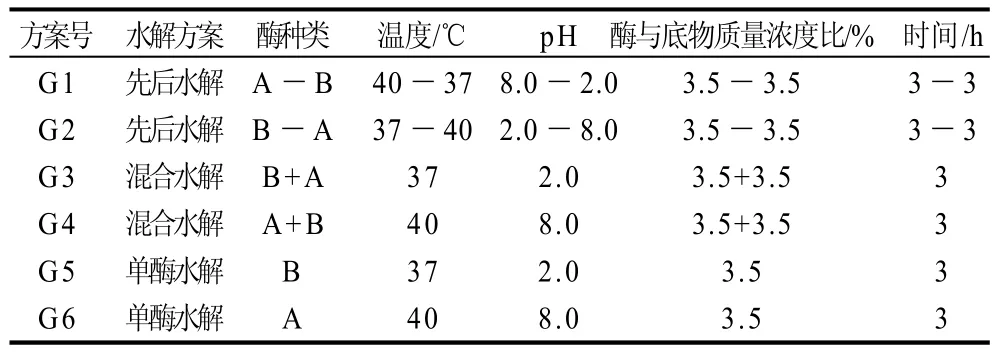
表5 单酶与复合酶水解的比较Table 5 Conditions for the hydrolysis of channel catfish skin gelatin with pepsin, trypsin and both of them in different orders of addition
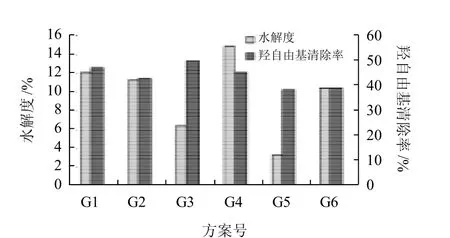
图7 复合酶水解胶原蛋白多肽组分对水解度和羟自由基抑制率的影响Fig.7 Comparisons of degree of hydrolysis and hydroxyl free radical scavenging rate obtained using different hydrolysis protocols
由图7可知,胰蛋白酶和胃蛋白酶复合酶解的工艺(即G3组实验)得到的水解产物清除羟自由基能力最强(49.92%),但其水解度仅为6.47%;而先用胰蛋白酶然后用胃蛋白酶酶解的工艺(即G1组试验)清除自由基的能力也很强(47.38%),且其水解度高达12.11%。由此可见,组合酶技术在制备高活力水解液上应用是可行的,采用复合酶解的方法能够有效提高水解效果,尤其适用于制备清除自由基能力更高的多肽产物。
3 结 论
鮰鱼皮明胶经过酶解之后产生多肽,多肽具有清除羟自由基的活性。胰蛋白酶水解鮰鱼皮明胶的最佳水解条件为温度40℃、pH7.5、酶与底物质量浓度比3.5%、底物质量浓度2.5g/100mL,酶解时间3h。水解液在胰蛋白酶最佳水解条件下水解3h之后,再经胃蛋白酶最适水解条件水解3h之后、得到的羟自由基清除率最高,达到47.38%。以上研究表明,鮰鱼皮明胶多肽对自由基有一定的清除作用,为开发具有抗衰老活性的功能性食品和化妆品提供理论和技术支持。
[1]郭瑶, 曾名勇, 崔文萱. 水产胶原蛋白及胶原多肽的研究进展[J]. 水产科学, 2006, 25(2): 101-104.
[2]陆剑锋, 万全, 殷章敏, 等. 中华鳖裙边胶原蛋白的提取及其特征[J].水产学报, 2010, 34(6): 801-808.
[3]焦道龙, 陆剑锋, 张伟伟, 等. 水产动物胶原蛋白的研究现状及发展趋势[J]. 食品科学, 2009, 30(17): 334-338.
[4]李素云, 王立芹, 郑稼琳, 等. 自由基与衰老的研究进展[J]. 中国老年学杂志, 2007, 27(10): 2046-2048.
[5]BIBHABASU H, RHITAJIT S, SANTANU B, et al. Comparative study of the antioxidant and reactive oxygen species scavenging properties in the extracts of the fruits of Terminalia chebula, Terminalia belerica and Emblica officinalis[J]. BMC Complement Altern Medicine, 2010, 10: 20.
[6]REDDY G K, ENWEMEKA C S. A simplified method for analysis of hydroxyproline in biological tissue[J]. Clinical Biochemistry, 1996, 29 (3): 225-229.
[7]吉中礼二, 佐藤守. 水产化学实验法[M]. 东京: 恒星社厚生阁, 1989: 57-60.
[8]ROSSMAN S, BERMAN M. Process for the production of gelatin from fish skins: Japan, 5093474[P].1992-03-03.
[9]赵新淮, 冯志彪. 大豆蛋白水解物水解度测定的研究[J]. 东北农业大学学报, 1995, 26(2): 178-180.
[10]颜军, 苟小军, 邹全付, 等. 分光光度法测定Fenton反应产生的羟基自由基[J]. 成都大学学报, 2009, 28(2): 91-93.
[11]高雯, 姜培荣, 张之佳, 等. 食品酶学原理与分析方法[M]. 哈尔滨:黑龙江科学技术出版社, 1991: 121-123.
[12]郭瑶. 罗非鱼皮胶原肽的制备及其抗氧化活性的制备[D]. 青岛: 中国海洋大学, 2006.
Enzymatic Preparation of Antioxidant Peptides from Channel Catfish (Ictalurus punctatus) Skin Gelatin
WANG Yun-gai,LIN Lin,LI Ming-hui,WENG Shi-bing,YE Ying-wang,JIANG Shao-tong,LU Jian-feng*
(College of Biotechnology and Food Engineering, Hefei University of Technology, Hefei 230009, China)
Five enzyme preparations were solely used to hydrolyze channel catfish (Ictalurus punctatus) skin gelatin and pepsin and trypsin were screened for further studies in view of higher hydroxyl free radical scavenging activity of the hydrolysates. Optimization of the conditions for trypsin hydrolysis was carried out using orthogonal array design L9(34) and the optimal hydrolysis conditions were determined as follows: temperature 40 ℃; pH 7.5; enzyme/substrate ratio (E/S) 3.5%; substrate concentration 2.5 g/100mL; and hydrolysis duration 3 h. In addition, pepsin and trypsin were used together for the two-step hydrolysis of channel catfish gelatin in different orders of addition or one-step hydrolysis, namely adding the two enzymes simultaneously. Initial trypsin hydrolysis for 3 h followed by another 3 h of pepsin hydrolysis resulted in the generation of peptides with the highest hydroxyl free radical scavenging rate, up to 47.38%.
channel catfish (Ictalurus punctatus);enzymatic hydrolysis;bioactive peptides;hydroxyl free radical
TS254.1
A
1002-6630(2010)19-0254-05
2010-06-30
安徽省重大科技攻关专项(08010301078);国家星火计划项目(2008GA710021);安徽省自然科学基金项目(090411018);安徽高校省级自然科学研究重点项目(KJ2009A106);国家自然科学基金项目(31000832)
王运改(1985—),女,硕士研究生,主要从事食品资源综合利用研究。E-mail:wangyungai@126.com
*通信作者:陆剑锋(1976—),男,副研究员,博士,主要从事水生动物资源的保护和综合利用研究。E-mail:Lujf@sibs.ac.cn



