王 静,杨丽君*,李兆杰**,赵 萌,宋晓华,刘玉敏
昆明系小鼠生物法定量测定水产品中河豚毒素
王 静,杨丽君*,李兆杰**,赵 萌,宋晓华,刘玉敏
(威海出入境检验检疫局,山东 威海 264205)
为建立昆明系小鼠定量测定河豚毒素(TTX)方法,选用体质量19~21g的昆明系小鼠作为实验对象,用不同质量浓度TTX溶液腹腔注射小鼠。结果显示:TTX致昆明系小鼠的半数致死量(LD50)为0.18μg,小鼠死亡时间与TTX注射剂量满足方程Y=e(0.357/X+1.005)。此外,采用体积分数0.5%乙酸溶液提取TTX,回收率达到90%以上,对样品的最低检测限为0.56μg/g。昆明系小鼠定量测定河豚毒素,准确、稳定、方便快捷,可用于水产品安全检测。
河豚毒素;半数致死剂量(LD50);昆明系小鼠;提取
河豚毒素(tetrodotoxin,TTX)是普遍存在于河豚鱼及其他生物体内的一种生物碱,它是自然界中毒性最强的非蛋白类神经毒素之一[1]。河豚鱼味道鲜美,营养丰富,日本、中国等亚洲国家的居民素有食用的习惯,但因TTX化学性质相当稳定,日晒、盐腌及一般烹饪手段均难以破坏,中毒后也缺乏有效的解救措施,故TTX中毒事件屡有发生,严重威胁人们的生命安全。
为了控制TTX中毒事件的发生,各国有关部门均采取了严格的管理措施,我国《水产品卫生管理法》虽然严格规定了河豚鱼的销售,但TTX中毒的现象时有发生。因此提高食用河豚鱼质量安全水平,不仅要加强安全监管,更重要的是不断完善基层的快速、定量检测TTX的方法。
目前,对TTX的检测方法有多种,如小鼠生物检测法、薄层色谱法、电泳法、酶联免疫法、柱后衍生液相色谱荧光检测法、气相色谱-质谱联用法、固相萃取-超过滤-液相色谱/质谱连用法、LC-MS联用法等[2-6]。色谱法及免疫法等方法虽然检测精度高,但操作繁琐,仪器价格昂贵,耗费大,一般多用于科研方面研究应用,不适于生产一线及流通过程中的快速检测。小鼠生物法是日本官方检测TTX的生物学方法[7-8],具有直观、快速、症状典型、易于操作、费用低,而检测精度能满足水产品安全监测要求等特点,也被国际上广泛采用。
小鼠生物法的基本原理是TTX注射剂量与小鼠死亡时间倒数存在确定关系[9],因此,可根据小鼠死亡时间来推断体内TTX含量。目前小鼠生物法国际上大都采用ddy系小白鼠,台湾学者试用ICR小鼠替代ddy小鼠,收到良好效果[10]。但目前国内尚无ddy系小鼠饲养点,ICR小鼠饲养点极少,本研究选用常见的昆明系小鼠(19~21g)作为试验动物,进行TTX定量检测方法研究,建立从提取到检测、系统的昆明系小鼠定量测定TTX方法,为水产品生产企业及检验机构快速准确的检测TTX,控制水产品质量安全,提供一定的参考依据依据。
1 材料与方法
1.1 材料与试剂
河豚肌肉组织取自威海某公司养殖东方红鳍豚,养殖环境受控,为无河豚毒素河豚;体质量为19~21g的雄性昆明系小鼠购自烟台绿叶制药有限公司实验动物中心,饲养参照GB 14925—2001《实验动物环境及设施》进行。
TTX标准品(纯度≥99%) 昆明科翔生物科技有限公司,于4℃保存。
TTX标准溶液:向1mg TTX干粉标准品中加入10mL体积分数为 0.1%的乙酸,溶解混匀,配制成100μg/mL母液。用微量移液器吸取100μg/mL母液1mL于100mL容量瓶中,加入0.1%乙酸溶液定容至100mL,即得到1.0μg/mL的标准溶液。以此标准溶液和0.1%乙酸溶液配制0.65~0.25μg/mL的梯度溶液,相邻质量浓度差为0.05μg/mL。
1.2 仪器与设备
CR22GⅢ离心机 日本日立公司。
1.3 方法
1.3.1 小鼠有效死亡的判定
用1mL注射器(配5号针头),分别抽取1mL不同质量浓度的TTX溶液,对小鼠进行腹腔注射。当TTX溶液完全注入小鼠腹腔时开始计时,如果注射时有1滴以上TTX溶液从小鼠腹内溢出,则判定小鼠死亡时间无效。
小鼠TTX中毒的典型症状为初期呼吸困难,急促,腹部收缩加快,反应迟钝,继而出现突然疾走,急跑急跳,四处乱窜,东倒西歪,翻转乱跳等挣扎动作,数十秒后,小鼠后腿剧烈抽搐,2~3次后爬卧不动,腹部呼吸逐渐微弱减慢,最后死亡。以停止呼吸作为判断死亡的标准。
1.3.2 TTX对昆明系小鼠半数致死量(LD50)的测定
将19~21g的昆明系小鼠随机分为4组,每组10只,配制TTX质量浓度为0.15、0.171、0.195、0.221μg/mL。给每组小鼠腹腔注射不同质量浓度的TTX溶液,每只注射1mL,记录小鼠死亡数量,用Bliss法,利用计算机BL-410程序计算得出TTX对昆明系小鼠的半数致死量(LD50)。
1.3.3 TTX剂量与小鼠死亡时间的关系
随机将昆明系小鼠分成9组,每组10只,体质量在19~21g。每组分别腹腔注射TTX质量浓度为0.25、0.30、0.35、0.40、0.45、0.50、0.55、0.60、0.65 μg/mL,每鼠注射1mL。记录每组小鼠的死亡时间,采用Microsoft Excel 2003软件,以TTX注射剂量为x轴,小鼠死亡时间为y轴,将有效数据作散点图。根据散点图,采用SPSS 11.0软件,将TTX注射剂量(X)和小鼠死亡时间(Y)采用曲线估计法中的S模型得出两者之间的经验方程。
1.3.4 经验方程的验证
取0.4μg/mL与0.6μg/mL两种不同质量浓度的TTX溶液,用相同方法腹腔注射小鼠,每个浓度注射15只小鼠并获得10个有效数据,取其平均值,将所得平均值分别代入经验方程,推算注射剂量;再根据剂量计算出TTX质量浓度,与0.4μg/mL和0.6μg/mL两个标准质量浓度相比,计算测定误差。
1.3.5 TTX提取方法回收率的测定
取不含TTX的河豚肌肉组织,匀浆器匀浆,称取10g于50mL离心管中,加入100μg/mL TTX 125μL(即12.5μg TTX),搅拌混匀,使TTX充分吸附。然后加入0.5%乙酸溶液11mL,充分混匀,沸水浴中煮沸10min,期间加以搅拌防止组织结块,沸后冷却至室温,20000×g离心20min,移取上清液于一干净50mL离心管中,另向沉淀中加入0.5%乙酸溶液11mL,充分混匀,沸水浴中煮沸5min,沸后冷却至室温,20000 ×g离心20min,取上清液,将两次离心上清液合并混匀,用0.5%乙酸定容至25mL。将此提取液腹腔注射小鼠,共注射10只,每只注射1mL,记录小鼠死亡时间,根据TTX剂量-小鼠死亡时间关系曲线及经验方程,计算提取液中TTX含量,与加入TTX标准品剂量相比,求出此提取方法的回收率。
1.3.6 昆明系小鼠测定TTX的最低检测限
取不含TTX的河豚肌肉组织,匀浆器匀浆,分别称取10g于4个不同的50mL离心管中,向其中各加入100μg/mL TTX 50、55.6、69.4、83.3μL,搅拌混匀,使TTX充分吸附。然后提取各个样品中的TTX,方法同上,最后将各提取液用0.5%乙酸分别定容至25mL。将此提取液腹腔注射小鼠,每个提取液注射10只,每只注射1mL,同时注射0.18、0.20、0.25、0.30μg/mL的标准TTX溶液作对照。同时以提取液作为空白对照注射10只小白鼠。记录每组小鼠死亡只数和死亡时间,据此判断昆明系小鼠测定TTX的最低检测限。
1.3.7 数据处理
采用SPSS 11.0软件。
2 结果与分析
2.1 TTX对昆明系小鼠半数致死量(LD50)的测定
通过对体质量19~21g的昆明系小鼠注射不同剂量的TTX,应用Bliss法测得TTX对昆明系小鼠半数致死量LD50及95%的可信限分别为0.18μg和0.171~0.190 μg/mL(表1)。
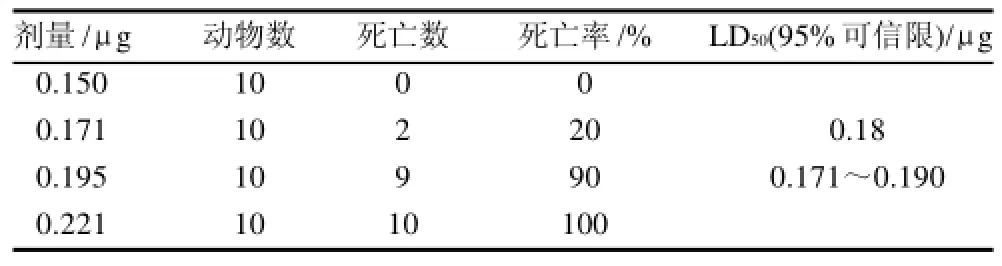
表1 TTX对昆明小鼠半数致死量的测定Table 1 LD50determination of TTX for Kunming strain mice
2.2 TTX剂量与小鼠死亡时间的关系
以注射剂量为自变量(X),小鼠死亡时间为因变量(Y),得出注射剂量与小鼠死亡时间呈自然指数关系(图1),符合曲线Y=e(0.357/X+1.005),R2=0.992。
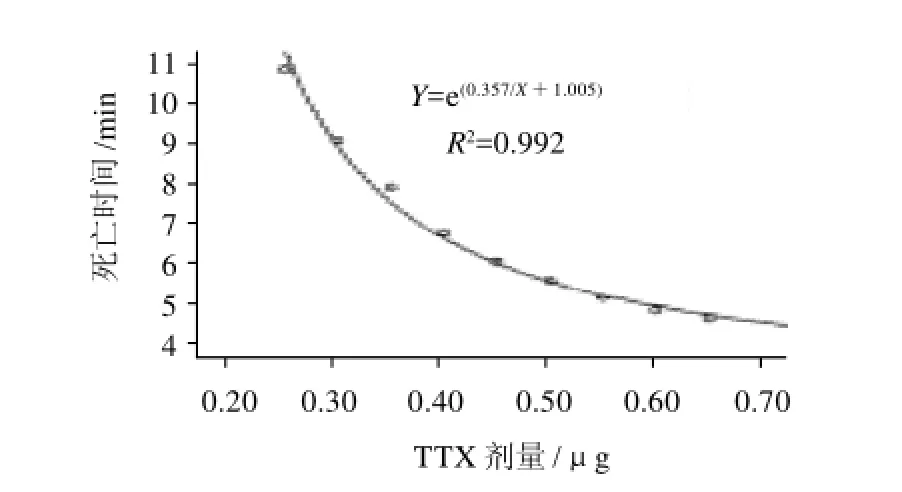
图1 TTX剂量-昆明系小鼠死亡时间关系曲线Fig.1 Curves of TTX dosage against mean death time of Kunming mice
2.3 方法验证结果
根据2.2节中注射剂量与小鼠死亡时间的自然指数关系方程,得出拟合曲线表达式:
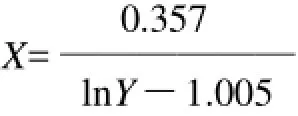
式中:X为TTX注射剂量/μg;Y为昆明系小鼠死亡时间/min。
将昆明系小鼠的死亡时间代入曲线方程,从而计算得到TTX剂量,即得TTX质量浓度。各取10个有效数据的平均数,分别为6.75min和4.95min,代入曲线方程,得出TTX质量浓度分别为0.394μg/mL和0.601μg/mL,取两位有效数字,即为0.39μg/mL和0.60μg/mL,与加入标准品质量浓度极为接近,符合性极好。
2.4 TTX提取方法回收率的测定
应用0.5%乙酸溶液煮沸并高速离心法提取TTX,可以使TTX的回收率大大提高,达到(90.4±3.7)%。实验结果见表2。
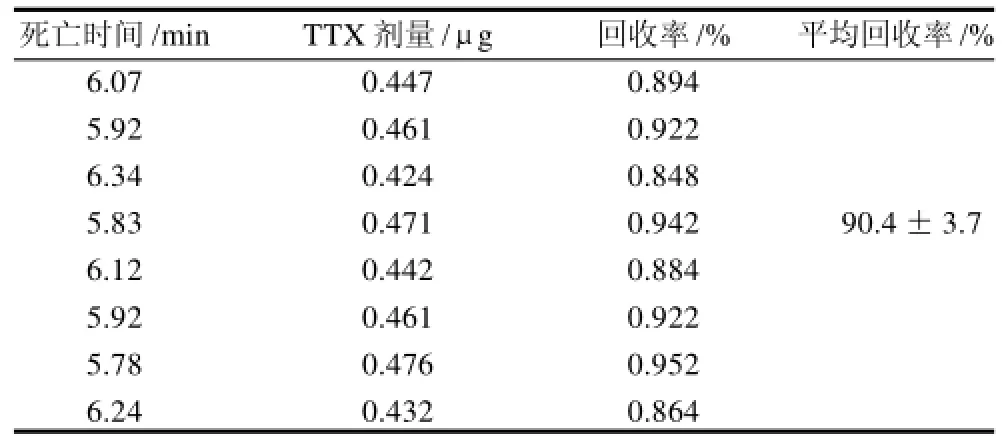
表2 TTX回收率实验结果Table 2 Recovery rates for TTX
2.5 昆明系小鼠测定TTX的最低检测限
向无毒河豚肌肉组织中添加不同剂量的TTX,使肌肉组织TTX含量分别为0.50、0.56、0.69、0.83μg/g。考虑90%左右的提取方法回收率,初步估计对应TTX提取液的质量浓度分别约为0.18、0.20、0.25、0.30μg/mL。根据实验观测,注射提取液空白对照的10只小鼠均未死亡,注射0.18μg/mL TTX提取液,小鼠仅有部分死亡(6只),而注射0.20、0.25、0.30μg/mL TTX提取液,小鼠全部死亡,且死亡时间与注射等质量浓度标准品相当。表明0.20μg TTX为昆明系小鼠的最低检测量,与此相对应,此法对样品的最低检测限为0.56μg/g。
3 讨 论
3.1 TTX对昆明系小鼠的LD50的分析
在实际毒素检测过程中,通常用鼠单位的方法表示毒素的浓度。根据鼠单位(MU)的定义,1MU指采用腹腔注射的方式,30min内杀死1只20g体质量的雄性ddy小鼠的毒素量[7,10],目前国际通用的鼠单位为日本学者测定的ddy系小鼠(1鼠单位=0.22μg TTX)。但因敏感性的不同,不同品系1MU所表示的TTX含量不同。Huang[10]以LD50作为1MU。TTX对台湾ICR小鼠的LD50为0.178μg,对日本ddy小鼠的LD50为0.22μg,张理等[11]研究得出TTX对北京ICR小鼠的LD50为0.159μg,对昆明系小鼠的LD50为0.165μg,华元渝等[12]研究得出TTX对ICR小鼠的LD50为0.1836μg,由此可见即使是同一品系小鼠,LD50也有差异,究其原因,可能存在异地实验或是TTX纯度不同等某些影响因素。而本实验得出TTX对昆明系小鼠的LD50为0.18μgTTX,较张理等[11]得出的LD50(0.165μg)稍高。
3.2 TTX注射剂量与昆明系小鼠死亡时间的曲线关系
许多研究表明,TTX注射剂量与小鼠死亡时间之间存在明显的曲线关系[9,12-14]。根据此规律国内有诸多采用ICR系或昆明系小鼠进行TTX检测方法的研究,但尚存在很多问题,如应用其他品系小鼠检测TTX,但却等同采用ddy系小鼠死亡时间与小鼠单位(MU)换算表,因不同品系对TTX的敏感性不同,故等同采用可能会产生较大误差;或是根据在一定注射剂量范围内TTX剂量与小鼠死亡时间倒数存在直线关系这一规律,由小鼠死亡时间推算TTX质量浓度,但这仅仅局限于TTX在一定剂量范围内,超出或低于此剂量便不适用。本实验得出了TTX注射剂量与昆明系小鼠死亡时间的自然指数关系,符合经验方程Y=e(0.357/X+1.005),且方法验证结果表明,采用此公式计算TTX质量浓度,误差很小,符合性非常好,此公式真正揭示了TTX致昆明系小鼠的死亡规律,对应用昆明系小鼠定量测定TTX更具有指导意义。
3.3 河豚毒素提取方法的改进
采用0.5%乙酸煮沸高速离心提取方法进行TTX的回收测定。结果显示用此法提取TTX,回收率可达(90.4± 3.7)%,这较其他文献报道的如0.1%乙酸提取法[7],乙酸酸化甲醇提取法[15]等都高,分析其原因,可能有以下几点:一是高浓度的乙酸可能有助于TTX的溶出;二是两次煮沸使TTX溶出更完全;三是高速离心使TTX损失更少。另外,离心法取代了传统的过滤法,可以大大加快样品的制备速度。传统的过滤法需要用较多的乙酸反复冲洗,易导致提取液体积的增加,扩大样品的稀释倍数,对于低毒组织的毒力测定非常不利。笔者通过实验验证还发现,应用乙酸酸化的甲醇法提取,存在一个严重问题:甲醇和乙酸会发生反应产生乙酸甲酯,而乙酸甲酯是一种有毒物质,会干扰结果的准确性。因此,应用0.5%乙酸煮沸高速离心的方法提取河豚毒素,更准确、更快速、更有效,为水产品生产企业及检测机构严格控制水产品安全提供了可靠的方法指导。
3.4 昆明系小鼠测定TTX的最低检测限
本实验采用方法对TTX的最低检测量0.20μg TTX,对样品的最低检测限为0.56μg/g。日本官方规定TTX含量小于10MU(ddy小鼠10个单位,相当于2.2μg/g)即可视为对人无毒,可以安全食用。2.2μg/g比本实验的毒素最低检测限0.56μg/g大了近4倍,反映出改进后的小鼠生物法的安全性和可靠性。
[1]WU Zhenlong, YANG Ying, XIE Liping, et al. Toxicity and distribution of tetrodotoxin-producing bacteria in puffer fish Fugu rubripes collected from the Bohai Sea of China[J]. Toxicon, 2005, 46(4): 471-476.
[2]王键伟. 河豚毒素的定量检测方法研究进展[J]. 国外医学: 卫生学分册, 1995, 22(2): 86-89.
[3]李秋芬, 徐怀恕. 河豚毒素(TTX)及其微生物起源[J]. 海洋通报,1994, 13(4): 86-91.
[4]李晓川, 林美娇. 河豚鱼及其加工利用[M]. 北京: 中国农业出版社, 1998: 112.
[5]骆和东, 贾宝珠, 朱宝平. 固相萃取-超过滤-液相色谱/质谱联用法测定织纹螺中的河豚毒素[J]. 色谱, 2007, 25(6): 917-921.
[6]李世平, 焦新安, 黄金林, 等. 河豚毒素两种定量检测方法的比较研究[J]. 扬州大学学报, 2004, 25(2): 58-60.
[7]厚生省生活卫生局监修. 食品卫生检查指针: 理化学编[M]. 东京: 日本食品卫生协会, 1991: 296-299.
[8]食品卫生协会(日). 食品卫生检验手册-理化检验手册[M]. 天津: 天津科技翻译出版社公司, 1993: 240-243.
[9]王亚丽, 王玉霞. 河豚毒素定量检测的研究进展[J]. 军事医学科学院院刊, 2002, 26(2): 151-153.
[10]HUANG Dongfang. Bioassay of tetrodotoxix using ICR mouse strain [J]. J Chin Biochem Soc, 1991, 20(2): 80-86.
[11]张理, 谢克勤, 赵金山, 等. 用昆明小鼠定量测试河豚毒素的研究[J].中国食品卫生杂志, 2004, 16(6): 497-500.
[12]华元渝, 顾志峰, 丁正峰, 等. 小鼠生物法快速定量检测河豚毒素[J].淡水渔业, 2004, 34(3): 22-25.
[13]JEN H C, LIN S J, LIN S Y, et al. Occurrence of tetrodotoxin and paralytic shellfish poisons in a gastropod implicated in food poisoning in southern Taiwan[J]. Food Additives & Contaminants: Part A, 2007, 24(8): 902-909.
[14]BEANI L, BIANCHI B, BUERRINI F, et al. High sensitivity bioassay of paralytic (PSP) and amnesic (ASP) algal toxins based on the fluorimetric detection of [Ca2+] in rat cortical primary cultures[J]. Toxicon, 2000, 38(9): 1283- 1297.
[15]林文銮, 黄惠莉, 陈少欣, 等. 河豚毒素的提取研究[J]. 华侨大学学报: 自然科学版, 1999, 20(4): 412-414.
Quantitative Detection of Tetrodotoxin Using Kunming Strain Mice
WANG Jing,YANG Li-jun*,LI Zhao-jie**,ZHAO Meng,SONG Xiao-hua,LIU Yu-min
(Weihai Entry-exit Inspection and Quarantine Bureau, Weihai 264205, China)
This study was aimed at establishing a laboratory method for the quantitative detection of tetrodotoxin (TTX). A bioassay was developed by injecting intraperitoneally TTX at various dosages to Kunming strain male mice with body weights of 19-21 g. Results indicated that the 50% lethal dose (LD50) of TTX for Kunming strain mice was 0.18μg. The relationship between TTX dosage and the mean death time of Kunming mice could be expressed as Y = e(0.357/X+1.005). In addition, a high recovery rate of TTX was achieved by using 0.5% (V/V) acetic acid to extract TTX from globefish, which reached up to 90%. However, the detection limit of the assay for samples was 0.56μg/g. Therefore, Kunming strain mice can be used to quantitatively determine TTX in an accurate, stable and convenient manner, which is promising in the safety control of fishery products.
tetrodotoxin;50% lethal dose (LD50);Kunming strain mouse;extraction
R155.5;TS254.1
A
1002-6630(2011)04-0181-04
2010-04-14
2009年国家质量监督检验检疫总局出入境检验检疫行业标准制(修)订计划项目(2009B138)
王静(1975—),女,工程师,学士,主要从事微生物学和海洋毒素研究。E-mail:wangjing7548@sohu.com
*并列第一作者:杨丽君(1969—),女,工程师,学士,主要从事微生物学和海洋毒素研究。E-mail:whylj2000@yahoo.com.cn
**通信作者:李兆杰(1981—),男,工程师,博士,主要从事海洋生物学、微生物学及海洋生物技术研究。
E-mail:hunterlee_81@163.com



