张敏洁,周晔文,杨 晨,刘 粤
上海市浦东新区公利医院,上海200135
人口老龄化是当今世界人口发展的趋势。随着年龄的增长,骨质下降,老年人骨质疏松症患病率升高[1],骨质疏松症已成为世界多发病,其发病率跃居慢性病第3位[2]。一项2018年流行病学调查显示,我国50岁以上人群骨质疏松患病率为19.2%,65以上人群骨质疏松患病率已达32%[3]。骨质疏松性骨折是骨质疏松最严重的后果[4]。林树峰等[5]研究表明,髋部是骨质疏松性骨折最常见的骨折部位。1990年全球髋部骨折数量约为166万人,预计到2050年将增长至626万人[6]。中国老年骨折发生率每10年增加30%,髋部骨折人数也呈4倍增加[7]。老年人发生骨折时常发生营养不良,继而导致跌倒与骨折[8];营养不良被认为是髋部骨折的危险因素[9],也是导致髋部骨折术后预后不良的主要因素[10]。目前,国内骨科对于老年人髋部骨折与营养不良间关系的研究较少。本研究旨在了解老年髋部骨折病人术前营养状况,营养风险对老年髋部骨折病人术后预后的影响以及营养风险筛查表在老年髋部骨折病人围术期的应用。
1 对象与方法
1.1 研究对象
回顾性分析上海浦东新区公利医院2020年1月—2020年12月收治的123例老年髋部骨折病人临床资料。纳入标准:①年龄≥60岁;②髋部骨折无合并其他部位骨折;③进行手术治疗;④无合并其他严重内科基础疾病。排除标准:①病人指标有缺失;②病理性或陈旧性骨折;③失访病人。最终纳入研究123例。
1.2 方法
营养风险筛查2002(Nutrition Risk Screening 2002,NRS 2002)是国际上采用循证医学方法制定的营养筛查工具[11],应用NRS2002,于病人入院时由责任护士进行数据采集,包括身高、体重、体质指数,询问是否病情严重、体质指数是否<20.5 kg/m2、近3个月内体重是否有丢失、近1个周内膳食摄入是否有减少,先进行初筛,如果有任何一个问题为“是”,进行下一步复筛。复筛内容包括:①疾病严重程度评分,0~3分;②营养状况受损评分,0~3分;③年龄评分,≥70岁得1分。如果所有问题的答案为“否”,每周进行1次评估。营养风险筛查评分<3分者为无营养风险,评分≥3分者为有营养风险,详情见表1、表2。根据营养风险筛查结果将病人分为有营养风险组(n=60)和无营养风险组(n=63)。

表1 营养风险筛查初筛表

表2 营养风险筛查复筛表
1.3 数据收集及整理
1.3.1 一般资料
包括性别、年龄、身高、体重、体质指数、骨折类型。
1.3.2 实验室检查指标
所有病人按照常规临床治疗抽取入院后第2天清晨与术后1 d清晨空腹静脉血,收集整理血液学营养指标白蛋白、总蛋白、前白蛋白、淋巴细胞计数。
1.3.3 其他指标
①术后并发症,包括深静脉血栓、感染、压疮等。 ②伤口愈合情况,甲级愈合:伤口愈合良好,局部无感染,脂肪液化;乙级愈合:伤口伴有急性和慢性的炎症或者伤口出现了脂肪液化;丙级愈合:伤口内局部脓肿形成。 ③住院时间。④术后3个月髋关节功能(Harris)评分。
1.4 统计学方法
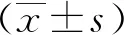
2 结果
2.1 两组临床资料比较(见表3)
2.2 两组术前实验室指标比较(见表4)
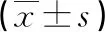
表4 两组术前实验室指标比较
2.3 两组术后实验室指标比较(见表5)
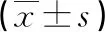
表5 两组术后实验室指标比较
2.4 两组伤口愈合情况及住院时间等比较(见表6)
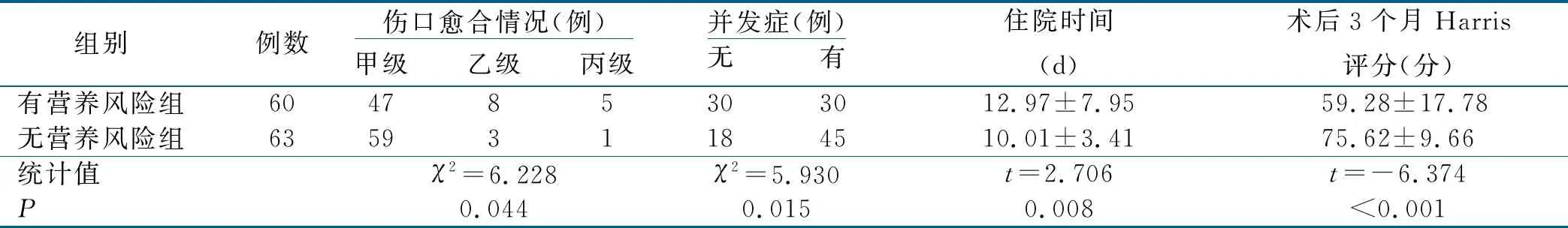
表6 两组伤口愈合情况及住院时间等比较
3 讨论
老年髋部骨折病人中营养不良和存在营养不良风险的病人比例较高[12]。一项研究表明,白蛋白和淋巴细胞计数是髋部骨折营养不良准确且简便的临床标志物,是适合鉴别营养不良病人的有效和可靠指标[13]。鲁攀攀等[14]研究表明,白蛋白和淋巴细胞计数广泛用于老年髋部骨折病人营养状况的评估,且与病人的营养状态及预后相关,可以作为评估营养状态的指标。Zhang等[15]的一项芸萃分析结果表明,白蛋白、前白蛋白、总蛋白是鉴别营养不良的有力指标。
3.1 实验室指标
3.1.1 术前白蛋白、总蛋白
本研究显示有营养风险组病人术前白蛋白、总蛋白值与无营养风险组比较差异无统计学意义,这与Sánchez-rodríguez等[16]研究结果一致, 但均值低于无营养风险组。
3.1.2 淋巴细胞计数
淋巴细胞计数不仅可反映营养情况,还可反映机体免疫情况。相关研究显示术前淋巴计数降低与老年髋部骨折病人术后感染性并发症相关[17]。淋巴细胞计数下降会引起机体免疫功能紊乱或降低,导致病人感染性并发症发生率上升[18]。本研究中有营养风险组的术前淋巴细胞计数均值较无营养风险组低,回顾性分析所有病人发生术后并发症率,有营养风险病人较高,但无营养风险组术后淋巴细胞计数下降程度较有营养风险组高,结果与相关研究不一致,可能与本研究样本量不足有关。
3.1.3 前白蛋白
前白蛋白的正常值为200~400 mg/L,轻度营养不良的范围为100~200 mg/L,严重营养不良者低于100 mg/L[19]。由于白蛋白半衰期较长,将近20 d[20],而前白蛋白半衰期只有2.5 d,更能评估营养状态[21]。本研究结果显示有营养风险组与无营养风险组术前白蛋白均值均低于200 mg/L,属于轻度营养不良,导致这一结果的可能原因为:老年人经常营养不良,尤其是髋部骨折的老年病人[9,22-23];高龄病人常存在一定消化吸收功能减退、蛋白质等营养物质摄入不足和或吸收不良[24];高龄病人多数存在机体合成蛋白能力降低[25],导致了老年髋部骨折病人不同程度的营养不良。
3.1.4 术后白蛋白
低蛋白血症是营养不良的表现之一[12],其定义为白蛋白低于35 g/L[26],余江等[27]研究表明,低白蛋白是髋部骨折病人术后并发症的危险因素。 Van Stijn等[28]认为白蛋白可作为老年髋部骨折病人术后并发症相关的指标。本研究显示无论是有营养风险组还是无营养风险组,术后白蛋白分别为(30.06±2.53)g/L、(31.05±3.85)g/L,均低于35 g/L,且有营养风险组减少程度大于无营养风险组,可能是因为:骨折导致的创伤和骨折术后能量及蛋白质需求量增加,会加重营养不良的状态[23];病人术前禁食、创伤引起机体代谢异常,增加蛋白质的分解,导致白蛋白减少[29];术中失血造成白蛋白降低[30]。
3.2 其他指标
3.2.1 住院时间
Lavernia等[31]调查了119例关节置换病人评估术前营养状况,对并发症发生率、住院时间等研究显示,营养状况好的病人住院时间缩短,加快康复。在本研究中,有营养风险的病人平均住院时间比无营养风险的病人多 3 d,这与Lavernia等[31]的研究结果一致。
3.2.2 伤口愈合情况
营养不良的髋关节置换病人容易发生伤口感染与伤口延迟愈合[31-32]。本研究中有营养风险组病人伤口愈合情况较差,甲级愈合率78.3%(47/60),而无营养风险组甲级愈合率93.7%(59/63)。
3.2.3 术后并发症
Wilson等[22]的一项回顾性队列研究显示,营养不良的老年髋部骨折病人在术后有70%的可能会发生术后并发症,Anbar等[33]的一项老年病人髋部骨折后的热量控制可减少并发症的随机对照研究结果显示,干预组总并发症发生率低于对照组,更多的能量摄入可改善临床结果,即并发症减少,尤其是与感染有关的并发症。本研究结果显示,有营养风险组的总并发症发生率大于无营养风险组(50.0%与28.6%,P<0.05)。
3.3 术后3个月Harris评分
Harris评分常用来评价髋关节置换的效果,其分值越高表明病人的髋关节功能恢复越好[34]。有研究表明营养不良或有营养风险的病人在出院后6个月内的髋关节功能较无营养不良病人差,营养状况在髋部骨折康复中具有重要作用[35]。本研究有营养风险组的Harris评分明显低于无营养风险组,有营养风险组为(59.28±17.78)分,小于70分提示髋关节功能差,无营养风险组为(75.62±9.66)分,提示髋关节功能尚可。
4 小结
综上所述,有营养风险的病人髋部骨折术后预后明显差于无营养风险病人。营养不良可能使老年髋部骨折病人在围术期存在更高风险[36],可以增加不良临床结果,是营养情况很强的预后指标,并且是术后可改变的危险因素[37]。通过营养风险筛查2002早期快速筛查出有营养风险的病人,以白蛋白、淋巴细胞计数等血液检验指标作为判断病人营养状态的指标,在围术期对病人进行营养干预,减少并发症的发生,促进伤口愈合,加强髋关节功能,改善老年病人预后[38]。在临床上应更加关注有营养风险的老年髋部骨折病人的营养状态,应予以干预营养状态,改善其临床结局。本研究仍存在有不足之处,为单中心回顾性研究,样本量较小,并且未展开干预性研究,需要今后开展大样本干预性研究加以证实。



